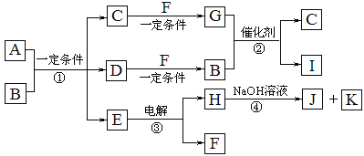
题目内容
【题目】下列反应中,第一步反应生成的沉淀经第二步反应后质量增加的是( )
A.将少量![]() 溶液加入NaOH溶液中,再滴加
溶液加入NaOH溶液中,再滴加![]() 溶液
溶液
B.将少量![]() 溶液滴加到NaCl溶液中,再滴加
溶液滴加到NaCl溶液中,再滴加![]() 溶液
溶液
C.将少量![]() 通入饱和
通入饱和![]() 溶液中,再通入过量
溶液中,再通入过量![]()
D.将少量![]() 溶液滴加到
溶液滴加到![]() 溶液中,再加入过量NaOH溶液
溶液中,再加入过量NaOH溶液
【答案】A
【解析】
A.将少量FeCl2溶液加入NaOH溶液中生成Fe(OH)2沉淀,再加入H2O2溶液,Fe(OH)2转化为Fe(OH)3,质量增加,故A正确;
B.将少量硝酸银溶液滴加到NaCl溶液中,生成AgCl白色沉淀,再滴加Na2S溶液,AgCl沉淀转化为黑色的Ag2S沉淀,沉淀质量减少,故B错误;
C.将少量CO2通入饱和Ca(OH)2溶液中,生成CaCO3沉淀,再通入过量Cl2,Cl2与水反应生成盐酸和次氯酸,CaCO3沉淀逐渐溶解,故C错误;
D.将少量Ba(OH)2溶液滴加到Al2(SO4)3溶液中,生成BaSO4和Al(OH)3沉淀,再加入过量NaOH溶液,Al(OH)3沉淀溶解,沉淀质量减少,故D错误;
故选A。

 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案【题目】室温下进行下列实验,根据实验操作和现象所得到的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 向苯酚钠溶液中滴加NaHSO3溶液,溶液变浑浊 | 苯酚酸性弱于H2SO3酸性 |
B | 向AgNO3溶液中逐滴加入浓度均为0.05 mol·L-1的NaI、NaCl混合溶液,有黄色沉淀生成 | Ksp(AgCl)>Ksp(AgI) |
C | 向FeCl3溶液中加入Cu粉,Cu粉溶解 | Cu的还原性大于Fe |
D | 向盛有H2O2溶液的试管中滴几滴酸化的FeCl2溶液,溶液变成棕黄色,一段时间后,溶液中有气泡出现 | 铁离子催化H2O2的分解 |
A.AB.BC.CD.D
【题目】PH3是粮食杀虫处理时常用的熏蒸杀虫剂;水煤气变换时产生的PH3能使催化剂中毒,必须脱除。回答下列问题:
(1)PH3通入NaClO溶液脱除PH3时,氧化产物是一种含氧酸且反应中氧化剂与还原剂的物质的量之比为4:1,则该含氧酸的化学式为______。
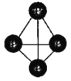
(2)已知下列键能数据及P4(白磷)分子结构:
化学键 | P-P | H-H | P-H |
|
键能/(kJmol-1) | 213 | 436 | 322 |
则反应4PH3(g)P4(g)+6H2(g)△H=______kJmol-1;某温度时平衡体系中c(PH3)=0.25molL-1,c(H2)=c(P4)=0.50molL-1,则平衡常数K=______。
(3)文献报道“反应6.25CO2(g)+Fe3O4(s)+3PH3(g)=3FePO4(s)+4.5H2O(g)+6.25C(s)”是铁触媒中毒的主导反应,其平衡常数Kp(Kp为以分压表示的平衡常数)的对数值与温度的关系如图所示:
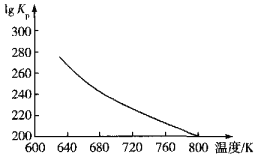
①该反应的△H______0(填“>”“<”或“=”)。
②图中lgKp=______[列出用分压p(CO2)、p(PH3)、p(H2O)表示的计算式]。
(4)反应(CH3)3AuPH3→(CH3)AuPH3+C2H6的历程如下:
第一步:(CH3)3AuPH3![]() (CH3)3Au+PH3(快反应)
(CH3)3Au+PH3(快反应)
第二步:(CH3)3Au![]() C2H6+CH3Au(慢反应)
C2H6+CH3Au(慢反应)
第三步:CH3Au+PH3![]() (CH3)AuPH3(快反应)
(CH3)AuPH3(快反应)
①反应的中间产物有PH3、______。
②第______步(填“一”“二”或“三”)反应的活化能最大。
(5)用Cu2+、Pd2+液相脱除PH3的反应为:PH3+2O2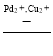 H3PO4,其他条件相同时溶解在溶液中O2的体积分数、PH3的净化效率与时间的关系如图所示:
H3PO4,其他条件相同时溶解在溶液中O2的体积分数、PH3的净化效率与时间的关系如图所示:
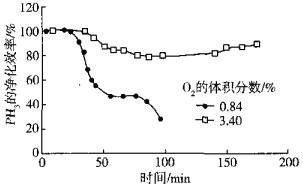
O2的体积分数大,PH3的净化效率高的原因是______(用碰撞理论等说明)。