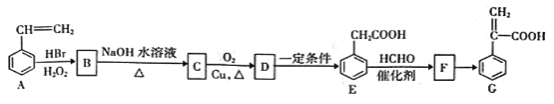
��Ŀ����
����Ŀ��Ϊ�ﵽ��Ӧ��ʵ��Ŀ�ģ�����ʵ�����ƻ������������ǣ� ��
A.Ϊ�ⶨһ��Ũ�ȵ�NaOH��Һ���ÿ������Ƿ�ת��Ϊ![]() ���÷�̪��ָʾ�����ñ�������Һ�ζ�
���÷�̪��ָʾ�����ñ�������Һ�ζ�
B.Ϊ�۲�Mg����![]() �����е�ȼ�գ���һ������ƿ���ռ���
�����е�ȼ�գ���һ������ƿ���ռ���![]() ���壬ȡһС�γ�ȥ��������Ĥ��Mg��������ǯ�гֵ�ȼ��Ѹ��Ͷ����������ƿ�ײ�
���壬ȡһС�γ�ȥ��������Ĥ��Mg��������ǯ�гֵ�ȼ��Ѹ��Ͷ����������ƿ�ײ�
C.Ϊ�Ƚ�Cl��SԪ�صķǽ�����ǿ������ͬ�����£��ⶨ��ͬŨ�ȵ�NaCl��Һ��![]() ��Һ��pHֵ
��Һ��pHֵ
D.��ʢ��ͭ��Ũ������Թܼ��ȣ������Թܵײ����ֻҰ�ɫ���壬Ϊ�������еİ�ɫ����Ϊ��ˮ����ͭ����ֱ�����Թ��м�������ˮ
���𰸡�A
��������
![]() Ϊ��ζ��ѡ���̪��ָʾ������Ӧ�յ���ָʾ���ı�ɫ��Χ�ӽ�����ⶨһ��Ũ�ȵ�NaOH��Һ���ÿ������Ƿ�ת��Ϊ
Ϊ��ζ��ѡ���̪��ָʾ������Ӧ�յ���ָʾ���ı�ɫ��Χ�ӽ�����ⶨһ��Ũ�ȵ�NaOH��Һ���ÿ������Ƿ�ת��Ϊ![]() ���÷�̪��ָʾ�����ñ�������Һ�ζ�����A��ȷ��
���÷�̪��ָʾ�����ñ�������Һ�ζ�����A��ȷ��
B.��һ������ƿ���ռ���![]() ���壬ȡһС�γ�ȥ��������Ĥ��Mg��������ǯ�г����еͲ�ȼ�գ�����Ͷ����������ƿ�ײ����������¼���ƿ�ײ��ܸ���ը�ѣ���B����
���壬ȡһС�γ�ȥ��������Ĥ��Mg��������ǯ�г����еͲ�ȼ�գ�����Ͷ����������ƿ�ײ����������¼���ƿ�ײ��ܸ���ը�ѣ���B����
C.�ⶨ��ͬŨ�ȵ�NaCl��Һ��![]() ��Һ��pHֵ���ɱȽ�����������������ԣ������ܱȽ�Cl��S�ķǽ����ԣ���C����
��Һ��pHֵ���ɱȽ�����������������ԣ������ܱȽ�Cl��S�ķǽ����ԣ���C����
D.����ֱ�����Թ��м�������ˮ��Ũ����ʣ��ʱ��ˮ�ų��������ȿɵ���Һ�ηɽ�����ȡ��Ӧ��İ�ɫ�������ձ��м�ˮ�ܽ�۲��Ƿ��Ϊ��ɫ����D����
��ѡA��

 Ӧ�����������Ĵ���ѧ������ϵ�д�
Ӧ�����������Ĵ���ѧ������ϵ�д�����Ŀ���о�����ȿ���CO��CO2��Ӧ�öԹ�����̬������������Ҫ�����塣
(1)CO��������������¯���������з�������Ҫ��ӦΪ��![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)![]()
![]() Fe(s)+CO2(g)����֪�÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ�����£�
Fe(s)+CO2(g)����֪�÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ�����£�
�¶�/��C | 1000 | 1150 | 1300 |
ƽ�ⳣ�� | 4.0 | 3.7 | 3.5 |
��÷�Ӧ��ƽ�ֳ�������ʽK=_________��H_________0(�>������<����=��)��
(2)CO2����������ȼ�ϼ״���һ�������·�����Ӧ��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)��Ϊ̽���÷�Ӧԭ������1 mol CO2��3 mol H2����һ�ݻ�Ϊ1L���ܱ������У��ֱ���250��C��T��C�·�����Ӧ����ü״������ʵ�����ʱ��ı仯����ͼ��ʾ��
CH3OH(g)+H2O(g)��Ϊ̽���÷�Ӧԭ������1 mol CO2��3 mol H2����һ�ݻ�Ϊ1L���ܱ������У��ֱ���250��C��T��C�·�����Ӧ����ü״������ʵ�����ʱ��ı仯����ͼ��ʾ��
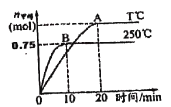
��������ش��������⣺
250��Cʱ����Ӧ��ǰ10min��ƽ������v(H2)_________molL-1min-1���ӷ�Ӧ��ʼ��ƽ�⣬CO2ת����Ϊ_________%����ͬ�¶��£���ijʱ�̸������к���1 mol H2��1.2mol CO2��0.8mol CH3OH��1.5 mol H2O�����ʱ��Ӧ������״̬Ϊ____________________________________(�������Ӧ��������С��������淴Ӧ����������ġ���ƽ��״̬��)��