题目内容
【题目】Ni2O3主要用作陶瓷、搪瓷和玻璃的着色剂,也可用于镍粉的制造。以镍粉废料为原料制备Ni2O3的工艺如下:
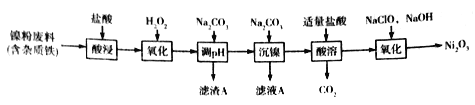
回答下列问题:
(1)Ni2O3中Ni的化合价为_________。
(2)提高“酸浸”、“酸溶”速率时,温度不宜过高,其原因是__________。
(3)加入H2O2“氧化”的离子方程式为_____________;滤渣A的主要成分是________(填化学式)。
(4)工艺中分步加入Na2CO3的作用是________;为提高原料的利用率,应控制加入NaClO与NaOH的物质的量之比为_________。
(5)工业上,用镍为阳极,电解0.1mol/L NiCl2溶液与一定量NH4Cl组成的混合溶液,可得高纯度的球形超细镍粉。当其他条件一定时,NH4Cl的浓度对阴极电流效率(电流效率是指电解时,在电极上实际沉积的物质的量与理论析出量之比)及镍的成粉率的影响如图所示:
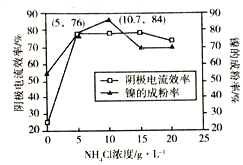
①为获得高纯度的球形超细镍粉,NH4Cl溶液的浓度最好控制为______mol/L.
②当NH4Cl溶液的浓度大于15g/L时,阴极有气体生成,导致阴极电流效率降低,请结合平衡移动原理解释其原因:_______________。
【答案】+3 温度高,HCl挥发加快 2Fe2++2H++H2O2=2Fe3++2H2O Fe(OH)3 将Fe3+和Ni2+分别沉淀出来 1:4 0.2 随着NH4+浓度增大,水解平衡NH4++H2O![]() NH3H2O+H+ 向右移动,H+浓度增大,导致阴极析出H2
NH3H2O+H+ 向右移动,H+浓度增大,导致阴极析出H2
【解析】
试题镍废料用盐酸酸浸后得酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等,加入过氧化氢氧化亚铁离子为铁离子,加入碳酸钠溶液调节溶液的pH,使铝离子、铁离子全部沉淀,过滤后的滤液中再加入碳酸钠沉淀镍离子得NiCO3,滤液A中含有NaCl等物质,将NiCO3再溶于盐酸,得氯化镍溶液,向其中加入次氯酸钠和氢氧化钠溶液可得Ni2O3,据此分析解答。
解析:镍废料用盐酸酸浸后得酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等,加入过氧化氢氧化亚铁离子为铁离子,加入碳酸钠溶液调节溶液的pH,使铝离子、铁离子全部沉淀,过滤后的滤液中再加入碳酸钠沉淀镍离子得NiCO3,滤液A中含有NaCl等物质,将NiCO3再溶于盐酸,得氯化镍溶液,向其中加入次氯酸钠和氢氧化钠溶液可得Ni2O3,则。
(1)氧元素是-2价,根据正负价代数和为0可知Ni2O3中Ni的化合价为+3价。
(2)由于浓盐酸易挥发,所以温度过高,导致HCl挥发加快,因此温度不能太高。
(3)根据以上分析可知加入H2O2氧化亚铁离子的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O;通过控制pH使铁离子转化为氢氧化铁沉淀,所以滤渣A的主要成分是Fe(OH)3。
(4)根据以上分析可知工艺中分步加入Na2CO3的作用是将Fe3+和Ni2+分别沉淀出来;在碱性溶液中次氯酸钠氧化镍离子的方程式为2Ni2++ClO-+4OH-=Ni2O3↓+Cl-+2H2O,所以为提高原料的利用率,应控制加入NaClO与NaOH的物质的量之比为1:4。
(5)①根据图可知,NH4Cl的浓度为10.7gL-1时,镍的成粉率最高,10.7g氯化铵是0.2mol,所以NH4Cl的浓度最好控制为0.2mol/L。
②当NH4Cl浓度大于15gL-1时,阴极有氢气生成,导致阴极电流效率降低。这是由于随着NH4+浓度增大,水解平衡NH4++H2O![]() NH3H2O+H+向右移动,H+浓度增大,导致阴极析出H2。
NH3H2O+H+向右移动,H+浓度增大,导致阴极析出H2。

 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案