题目内容
【题目】某化学兴趣小组在实验室制取漂白粉,并探究氯气与石灰乳反应的条件和产物。
已知:①二氧化锰与浓盐酸反应可制备氯气,同时生成MnCl2;
②氯气和碱的反应为放热反应。温度较高时,氯气和碱还能发生如下反应:3Cl2+6NaOH ![]() 5NaCl+NaClO3+3H2O
5NaCl+NaClO3+3H2O
该兴趣小组设计了下列实验装置,进行实验。
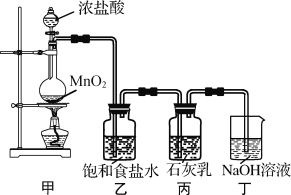
请回答下列问题:
(1)①甲装置用于制备氯气,乙装置的作用是____。
②实验室用足量NaOH溶液吸收从浓盐酸和MnO2反应体系中导出的气体。当吸收温度不同时,生成的产物可能是NaClO、NaClO3、NaCl中的两种或三种。下列说法不正确的是___。(填字母)
A.若产物为NaClO3、NaCl,则参加反应的氧化剂和还原剂的物质的量之比为1∶5
B.若产物为NaClO、NaCl,则吸收后的溶液中n(NaClO)=n(NaCl)
C.若产物为NaClO、NaClO3、NaCl,则NaOH与Cl2相互反应的物质的量之比为2∶1
(2)小组成员发现,产物中Ca(ClO)2的质量明显小于理论值。他们讨论后认为,其可能原因是部分氯气未与石灰乳反应而逸出,以及温度升高。为了探究反应条件对产物的影响,他们另取一定量的石灰乳,缓慢匀速地通入足量氯气,得出了Ca(ClO)2、Ca(ClO3)2两种物质的物质的量(n)与反应时间(t)的关系曲线,粗略表示为下图(不考虑氯气和水的反应)。
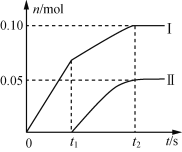
①图中曲线II表示___(填物质的化学式)的物质的量随反应时间变化的关系;
②所取石灰乳中含有Ca(OH)2的物质的量为___mol;
(3)为了提高Ca(ClO)2的产率,可对丙装置作适当改进。请你给出一种改进方法___。
【答案】除去氯气中混有的氯化氢 AB Ca(ClO3)2 0.5 将丙装置浸在盛有冷水的水槽中
【解析】
装置甲用于制取氯气,利用浓盐酸制取的氯气中常含有HCl气体,需要除杂,利用饱和食盐水除去氯气中的HCl,氯气与石灰乳反应制取漂白粉,最后用NaOH溶液吸收尾气。
(1) ①利用浓盐酸制取的氯气中常含有HCl气体,HCl也会与Ca(OH)2发生反应,使得有效成分含量降低,需要除杂,乙装置的作用就是用于除去氯气中的HCl;
答案是除去氯气中混有的氯化氢;
②A. 若产物为NaClO3、NaCl,化学方程式6NaOH+3Cl2=5NaCl+NaClO3+3H2O,根据方程式可知,氯气化合价升高得到NaClO3,只有0.5mol,而氯气化合价降低得到NaCl有2.5mol;氧化剂、还原剂均为氯气,其物质的量之比为2.5:0.5=5:1,A项错误;
B. 浓盐酸和MnO2反应体系中导出的气体中含氯气和HCl,氯气与NaOH反应生成NaClO和NaCl的方程式2NaOH+Cl2=NaCl+NaClO+H2O,NaClO和NaCl的物质的量之比为1:1,但是HCl也会与NaOH反应生成NaCl,因此比例不再是1:1,B项错误;
C.不管是NaCl、NaClO还是NaClO3中,Na和Cl的比例均为1:1,1mol氯气中含有2molCl原子,根据原子守恒,则NaOH和Cl2的比例为1:2,C项正确;
答案为AB;
(2)①反应刚开始的时候,氯气与Ca(OH)2生成Ca(ClO)2,溶液的温度并不高,虽然反应放热,温度逐渐升高,氯气与Ca(OH)2反应生成Ca(ClO3)2,所以曲线Ⅱ表示的是Ca(ClO3)2的物质的量随反应时间变化的关系;
答案为Ca(ClO3)2;
②根据图像可知,Ca(ClO)2的物质的量为0.1mol,Ca(ClO3)2的物质的量为0.05mol,根据化学方程式2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O,6Ca(OH)2+6Cl2=5CaCl2+Ca(ClO3)2+6H2O,则总共消耗Ca(OH)2的物质的量为0.1mol×2+0.05mol×6=0.5mol;
答案为0.5;
(3)要提高Ca(ClO)2的产率,就需要控制反应的温度,可以将装置丙放入冰水中;
答案是将丙装置浸在盛有冷水的水槽中。

 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案