题目内容
【题目】臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压放电管来制取臭氧:3O2![]() 2O3。
2O3。
(1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为_______ g·mol-1(保留一位小数)。
(2)将8 L氧气通过放电管后,恢复到原状况,得到气体6.5 L,其中臭氧为________ L。
(3)在臭氧发生装置中装入氧气100 mL,经反应最后气体体积变为95 mL(体积均在标准状况下测定),则混合气体的密度是____________g·L-1(保留一位小数)
(4)实验室将氧气和臭氧的混合气体0.896 L(标准状况),通入盛有20.0 g铜粉的反应容器中,充分加热后,粉末的质量最终变为21.6 g。则原混合气中臭氧的体积分数______
【答案】35.6 3 1.5 50%
【解析】
(1)首先列三段式,再利用平均摩尔质量等于气体的总质量与总物质的量之比分析解答;
(2)利用差量法根据化学方程式列比例式解题;
(3)根据质量守恒定律可知,反应后混合气体的质量等于反应前氧气的质量,计算出反应前氧气的物质的量,再计算反应前氧气的质量,再根据![]() 计算混合气体的密度;
计算混合气体的密度;
(4)再根据n(混合气体)=![]() ,再利用氧原子守恒混合气体中含有的氧原子等于增加的质量中氧原子的数目解题。
,再利用氧原子守恒混合气体中含有的氧原子等于增加的质量中氧原子的数目解题。
(1)假设有1molO2,则可列出三段式:
3O2![]() 2O3
2O3
起始 1mol 0
反应 0.3mol 0.2mol
剩余 0.7mol 0.2mol
则反应后所得气体为0.2molO3和0.7molO2,共0.9mol,反应前后气体总质量不变,混合气体的总质量为m=1mol×32g/mol=32g,则所得混合气的平均摩尔质量为![]() ;
;
故答案为:35.6;
(2)此题可根据差量法计算,设生成臭氧的体积为X,则:
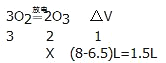
列方程式得![]() ,X=3L;
,X=3L;
故答案为:3;
(3)反应前氧气的物质的量为![]() ,故反应前氧气的质量为
,故反应前氧气的质量为![]() ,根据质量守恒定律可知,反应后混合气体的质量等于反应前氧气的质量,故反应后混合气体的密度为,
,根据质量守恒定律可知,反应后混合气体的质量等于反应前氧气的质量,故反应后混合气体的密度为,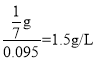
故答案为:1.5;
(4)![]() ,设臭氧的体积分数为a,根据氧原子守恒
,设臭氧的体积分数为a,根据氧原子守恒
0.04mol×a×3+0.04mol×(1-a)×2=![]()
解得a=50%;
故答案为:50%。

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案【题目】(1)已知在一定条件下发生反应:A+B=C+D,14gA和9gB恰好完全反应生成0.5molC和1gD则物质C的摩尔质量为____________;
(2)某1L混合溶液中所含离子的个数比如下表,则M离子可能为(_______)
所含离子 | NO3- | SO42- | Cu2+ | M |
个数比 | 4 | 1 | 2 | 1 |
A.Ba2+ B.Mg2+ C.Cl- D.Na+
(3)已知a g气体X2中含有b个X原子,那么c g该气体在标准状况下的体积是____________;
(4)把V L含有MgSO4与K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为Mg(OH)2;另一份加入含b mol BaCl2的溶液,恰好使SO![]() 完全沉淀为BaSO4,则原混合溶液中钾离子的物质的量浓度为________。
完全沉淀为BaSO4,则原混合溶液中钾离子的物质的量浓度为________。


