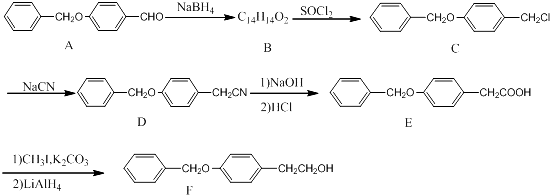
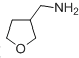
题目内容
【题目】锰的单质及其化合物在生产、生活中有广泛应用。
(1)碱性锌锰电池广泛应用于日常生活。电池的总反应式为:Zn(s)+2MnO2(s)+2H2O(l)===Zn(OH)2(s)+2MnOOH(s)。该电池的正极反应式为 。
(2)某学习小组拟以废旧干电池为原料制取锰,简易流程如下:
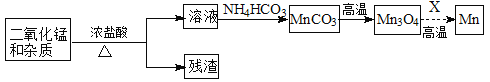
①加入浓盐酸溶解废旧电池内黑色物质过程中保持通风,其原因是 。
②从产品纯度、环保等角度考虑,X宜选择 (填代号)。
A.焦炭 B.铝 C.氢气 D.一氧化碳
③写出碳酸锰在空气中灼烧生成四氧化三锰的化学方程式 。
(3)电解硫酸锰溶液法制锰又叫湿法冶锰。以菱锰矿(主要成份是MnCO3,主要杂质是Fe2+、Co2+、Ni2+)为原料制备锰的工艺流程如下:
![]()
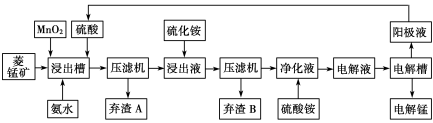
已知:NiS 、CoS均难溶于水。部分氢氧化物的pH如下表:(若某离子浓度小于等于105mol·L1,则认为完全沉淀)
物质 | Fe(OH)2 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 | Fe(OH)3 |
开始沉淀pH | 7.5 | 7.7 | 7.6 | 8.3 | 2.7 |
完全沉淀pH | 9.7 | 8.4 | 8.5 | 9.8 | 3.8 |
①浸出槽内MnO2的作用是(用离子方程式表示) 。
②加入氨水调节浸出槽中溶液的pH范围为 。
③电解槽阴极的电极反应式为 。
【答案】(1)MnO2+H2O+e=MnOOH+OH;(2)①二氧化锰与浓盐酸反应会产生有毒的氯气;② C; ③ 6MnCO3+O2![]() 2Mn3O4+6CO2;(3)①MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;②3.8≤pH<8.3;③Mn2++2e=Mn。
2Mn3O4+6CO2;(3)①MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;②3.8≤pH<8.3;③Mn2++2e=Mn。
【解析】
试题分析:(1)正极上得到电子,化合价降低,发生还原反应,Mn的化合价降低,MnO2在正极上得电子,根据总电极反应式为:MnO2+H2O+e-=MnOOH+OH-;(2)①废电池中含有MnO2,MnO2和浓盐酸反应产生Cl2,MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,氯气有毒,因此注意通风;②A、用焦炭,得到Mn含有焦炭,且容易产生温室气体,故错误;B、Mn中可能含有未反应铝,产品不纯,故错误;C、用氢气得到的是水,对环境无污染,故正确;D、CO有毒,未反应的CO污染空气,故错误;③MnCO3中Mn为+2价,Mn3O4中Mn为+8/3价,化合价升高,氧气参与反应,反应方程式为6MnCO3+O2
MnCl2+Cl2↑+2H2O,氯气有毒,因此注意通风;②A、用焦炭,得到Mn含有焦炭,且容易产生温室气体,故错误;B、Mn中可能含有未反应铝,产品不纯,故错误;C、用氢气得到的是水,对环境无污染,故正确;D、CO有毒,未反应的CO污染空气,故错误;③MnCO3中Mn为+2价,Mn3O4中Mn为+8/3价,化合价升高,氧气参与反应,反应方程式为6MnCO3+O2![]() 2Mn3O4+6CO2;(3)①根据流程图以及信息,弃渣A为Fe(OH)3,MnO2的作用是把Fe2+氧化成Fe3+,然后调节pH除去Fe3+,因为Fe(OH)3全部变为沉淀的时,Mn元素没有沉淀,如果是Fe(H)2完全沉淀,则Mn一部分全化成沉淀,MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;②氨水调节pH,使Fe3+变成Fe(OH)3,减少Mn的损耗,因此pH的范围是3.8≤pH<8.3;③阴极是得电子的,Mn2++2e-=Mn。
2Mn3O4+6CO2;(3)①根据流程图以及信息,弃渣A为Fe(OH)3,MnO2的作用是把Fe2+氧化成Fe3+,然后调节pH除去Fe3+,因为Fe(OH)3全部变为沉淀的时,Mn元素没有沉淀,如果是Fe(H)2完全沉淀,则Mn一部分全化成沉淀,MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;②氨水调节pH,使Fe3+变成Fe(OH)3,减少Mn的损耗,因此pH的范围是3.8≤pH<8.3;③阴极是得电子的,Mn2++2e-=Mn。