题目内容
【题目】某化合物通过化合反应生成,向其水溶液中加入足量Na2O2,最终有白色沉淀产生。下列化合物中符合上述条件的是
A.Ca(HCO3)2 B.Na2S C.FeI2 D.AlCl3
【答案】A
【解析】
试题分析:过氧化钠具有氧化性,过氧化钠与水反应生成氢氧化钠,Ca(HCO3)2与氢氧化钠反应生成碳酸钙沉淀,故A正确;Na2S被氧化为S单质,故B错误;FeI2生成红褐色氢氧化铁沉淀和碘单质,故C错误;AlCl3与过量氢氧化钠生成四羟基合铝酸钠,故D错误。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案【题目】锰的单质及其化合物在生产、生活中有广泛应用。
(1)碱性锌锰电池广泛应用于日常生活。电池的总反应式为:Zn(s)+2MnO2(s)+2H2O(l)===Zn(OH)2(s)+2MnOOH(s)。该电池的正极反应式为 。
(2)某学习小组拟以废旧干电池为原料制取锰,简易流程如下:
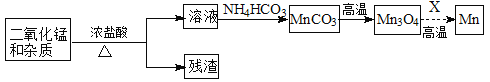
①加入浓盐酸溶解废旧电池内黑色物质过程中保持通风,其原因是 。
②从产品纯度、环保等角度考虑,X宜选择 (填代号)。
A.焦炭 B.铝 C.氢气 D.一氧化碳
③写出碳酸锰在空气中灼烧生成四氧化三锰的化学方程式 。
(3)电解硫酸锰溶液法制锰又叫湿法冶锰。以菱锰矿(主要成份是MnCO3,主要杂质是Fe2+、Co2+、Ni2+)为原料制备锰的工艺流程如下:
![]()
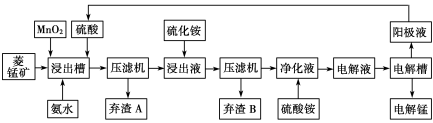
已知:NiS 、CoS均难溶于水。部分氢氧化物的pH如下表:(若某离子浓度小于等于105mol·L1,则认为完全沉淀)
物质 | Fe(OH)2 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 | Fe(OH)3 |
开始沉淀pH | 7.5 | 7.7 | 7.6 | 8.3 | 2.7 |
完全沉淀pH | 9.7 | 8.4 | 8.5 | 9.8 | 3.8 |
①浸出槽内MnO2的作用是(用离子方程式表示) 。
②加入氨水调节浸出槽中溶液的pH范围为 。
③电解槽阴极的电极反应式为 。