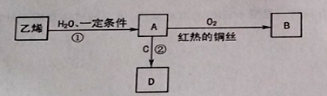
题目内容
【题目】铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3 → Cu(NO3)2+NO↑+NO2↑+H2O (方程式未配平,不考虑 2NO2 ![]() N2O4)。
N2O4)。
(1)硝酸在该反应中体现的性质有_________________ _。
(2)如果参加反应的Cu和HNO3的物质的量之比是3:10,写出并配平该反应的离子方程式
_________ 。
(3)0.004molCu被硝酸完全溶解后,Cu失去的电子数是____________,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量是____________,在标准状况下若将收集NO和NO2的集气瓶倒立于水中,通入一定量的氧气充分反应后发现无气体剩余,则通入O2的体积为________ mL;
【答案】(1)氧化性、酸性(2分)
(2)3Cu + 10H++ 4NO3-= 3Cu2++NO↑+3NO2↑+5H2O(2分)
(3)0.008NA(2分);0.012mol(2分) ;44.8mL(2分) ;
【解析】
试题分析:(1)硝酸和铜的反应中硝酸表现氧化性、酸性。(2)同和额硝酸的比例为3:10,则3摩尔铜失去6摩尔电子,则生成3摩尔硝酸铜,只有4摩尔硝酸表现氧化性,则一氧化氮和二氧化氮的物质的量分别为xmol,ymol,则有x+y=4 3x+y=6,则解x=1,y=3,即一氧化氮的系数为1,二氧化氮的系数为3,根据原子和电荷守恒配平方程式为:3Cu + 10H++ 4NO3-= 3Cu2++NO↑+3NO2↑+5H2O。(3)0.004摩尔铜失去0.008NA电子;若一氧化氮和二氧化氮的物质的量相等,则为xmol,则有3x+x=0.008,x=0.002,铜离子结合的硝酸的物质的量为0.008摩尔,则消耗的硝酸的总物质的量为0.008+0.002+0.002=0.0.012mol ;根据方程式计算,4NO+3O2+2H2O=4HNO3 4NO2+O2+2H2O=4HNO3,0.002摩尔一氧化氮消耗氧气的物质的量为0.0015摩尔,二氧化氮消耗的氧气的物质的量为0.0005摩尔,则氧气总物质的量为0.0015+0.0005=0.002摩尔,标况下体积为0.002×22.4=44.8mL。

【题目】锰的单质及其化合物在生产、生活中有广泛应用。
(1)碱性锌锰电池广泛应用于日常生活。电池的总反应式为:Zn(s)+2MnO2(s)+2H2O(l)===Zn(OH)2(s)+2MnOOH(s)。该电池的正极反应式为 。
(2)某学习小组拟以废旧干电池为原料制取锰,简易流程如下:
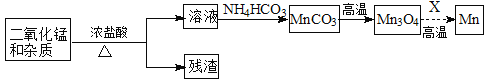
①加入浓盐酸溶解废旧电池内黑色物质过程中保持通风,其原因是 。
②从产品纯度、环保等角度考虑,X宜选择 (填代号)。
A.焦炭 B.铝 C.氢气 D.一氧化碳
③写出碳酸锰在空气中灼烧生成四氧化三锰的化学方程式 。
(3)电解硫酸锰溶液法制锰又叫湿法冶锰。以菱锰矿(主要成份是MnCO3,主要杂质是Fe2+、Co2+、Ni2+)为原料制备锰的工艺流程如下:
![]()
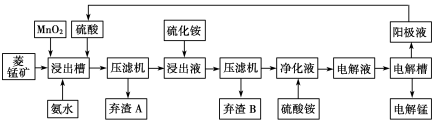
已知:NiS 、CoS均难溶于水。部分氢氧化物的pH如下表:(若某离子浓度小于等于105mol·L1,则认为完全沉淀)
物质 | Fe(OH)2 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 | Fe(OH)3 |
开始沉淀pH | 7.5 | 7.7 | 7.6 | 8.3 | 2.7 |
完全沉淀pH | 9.7 | 8.4 | 8.5 | 9.8 | 3.8 |
①浸出槽内MnO2的作用是(用离子方程式表示) 。
②加入氨水调节浸出槽中溶液的pH范围为 。
③电解槽阴极的电极反应式为 。