题目内容
【题目】酸雨形成的原理之一可表示如下:
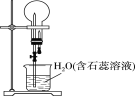
含硫燃料![]() A
A![]() B
B![]() 硫酸
硫酸
请回答下列问题。
(1)A的化学式为__________,B的化学式为__________________________________。
(2)三个反应中,不属于氧化还原反应的是________(填序号)。
(3)SO2中硫元素显+4价,它可以降低到0价,利用这一性质可在工厂的烟道气中通入合适的________(填“氧化剂”或“还原剂”)除去SO2,达到减少污染的目的。
(4)雨水的pH小于5.6时,就判定为酸雨。已知pH=-lgc(H+),经测定某次雨水所含酸性物质只有硫酸,且其浓度为5×10-5mol·L-1,则这次降雨________(填“是”或“不是”)酸雨。
(5)火力发电厂燃烧的煤中含有大量的硫,其排出的废气中往往含有SO2、CO2等。为了除去有害的SO2气体,在英国已进行了一个研究,结果表明:高烟囱可以有效降低地面SO2的浓度。在20世纪60年代到70年代的10年间,由发电厂排放的SO2增加了35%,但由于高烟囱的建造,地面SO2浓度降低了30%之多。
①你认为减少酸雨产生可采取的措施是__________(填字母)。
A.少用煤作燃料 B.把工厂的烟囱建高
C.燃料脱硫 D.把工厂迁移到农村
E.开发新能源
②请从全球环境保护的角度,分析这种建高烟囱的方法是否可取?________(填“可取”或“不可取”),理由是__________________________________________________。
【答案】SO2 SO3 ③ 还原剂 是 ACE 不可取 未减少二氧化硫的总排放量
【解析】
(1)含硫燃料在氧气中燃烧往往生成SO2,SO2经催化氧化生成SO3,SO3与水反应生成硫酸。
(2)从价态是否变化的角度分析判断。
(3)二氧化硫中硫的价态降低,需要加还原剂提供电子;
(4)先算H+浓度,再算pH,然后与5.6比较。
(5)建立“地球村”的理念,设法从根本上解决污染问题。
(1)含硫燃料燃烧往往生成SO2,二氧化硫在催化剂、加热条件与氧气反应生成SO3,所以A和B的化学式分别为SO2、SO3;
(2)所给的三个反应,前2个反应明显是氧化还原反应,第3个反应中元素的价态没有发生变化,属于非氧化还原反应;
(3) 此方案的目标是将二氧化硫中+4价的硫降为0价,所以需要外加还原剂来实现;
(4)硫酸的浓度为5×10-5mol·L-1,所以H+的浓度为10-4mol·L-1,该溶液的pH=-lgc(H+)=4,pH明显小于5.6,所以这次降雨属于酸雨;
(5)①燃煤中往往含有硫元素,少用煤作燃料或将燃煤进行脱硫处理,都可以较好地降低二氧化硫的排放量,从而减少硫酸型酸雨的产生。开发新能源可以更有效地减少酸雨的产生,答案选ACE;
②从全球环境保护的角度来看,建设烟囱的方法不可取。因为这种做法,实质上并未减少二氧化硫的总排放量,只是导致当地的二氧化硫的含量偏低,大量的二氧化硫随空气流动扩散到了别处。

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
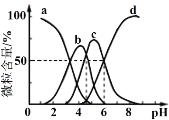
暑假接力赛新疆青少年出版社系列答案【题目】某实验探究小组研究320 K时N2O5的分解反应:2N2O5![]() 4NO2+O2。如图是该小组根据所给表格中的实验数据绘制的。下列有关说法正确的是
4NO2+O2。如图是该小组根据所给表格中的实验数据绘制的。下列有关说法正确的是
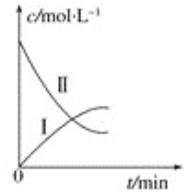
t/min | 0 | 1 | 2 | 3 | 4 |
c(N2O5)/mol/L | 0.160 | 0.114 | 0.080 | 0.056 | 0.040 |
c(O2)/mol/L | 0 | 0.023 | 0.040 | 0.052 | 0.060 |
A.曲线Ⅰ是N2O5的浓度变化曲线
B.曲线Ⅱ是O2的浓度变化曲线
C.N2O5的浓度越大,反应速率越快
D.升高温度对该反应速率无影响
【题目】含氮的化合物广泛存在于自然界,是一类非常重要的化合物.回答下列有关问题:
(1)在一定条件下;2N2(g)+6H2O(g)=4NH3(g)+3O2(g)。已知该反应相关的化学键键能数据如表一:
表一:
化学键 | | H-O | N-H | O=O |
E/(kJ/mol) | 946 | 463 | 391 | 496 |
则该反应的△H=___________kJ/mol
(2)在恒容密闭容器中充入2 molNO2与1molO2发生反应如下:
4NO2(g)+O2(g)![]() 2N2O5(g)
2N2O5(g)
①已知在不同温度下测得N2O5的物质的量随时间的变化如图1所示.常温下,该反应能逆向自发进行,原因是____________________________________________。
②下列有关该反应的说法正确的是___________。
A.扩大容器体积,平衡向逆反应方向移动,混合气体颜色变深
B.恒温恒容,再充入2molNO2和1molO2,再次达到平衡时NO2转化率增大
C.恒温恒容,当容器内的密度不再改变,则反应达到平衡状态
D.若该反应的平衡常数增大,则一定是降低了温度
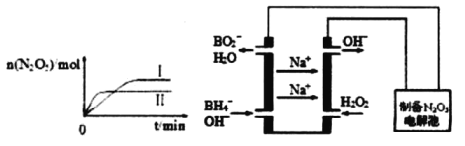
(3)N2O5是一种新型绿色硝化剂,其制备可以用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5,工作原理如图。则硼氢化钠燃料电池的负极反应式为______________________。
(4)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种。下表二是常温下浓度均为0.01mol/L的X、Y、Z、W溶液的pH。将X、Y、Z各lmol同时溶于水中得到混合溶液,则混合溶液中各离子的浓度由大到小的顺序为______________________。
0.01mol/L的溶液 | X | Y | Z | W |
pH | 12 | 2 | 8.5 | 4.5 |
(5)氮的氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
I: 2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
II: 2NO(g)+Cl2(g)![]() 2ClNO(g) K2
2ClNO(g) K2
①4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=___________(用K1、K2表示)
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=___________(用K1、K2表示)
②在恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.1molCl2,10min时反应Ⅱ达到平衡测得10min内v(ClNO)=7.5×10-3mol/(L·min),则平衡时NO的转化率α1=___________;其他条件不变,反应Ⅱ在恒压条件下进行,平衡时NO的转化率α2=___________α1 (填“>”“<”或“=”)