题目内容
【题目】含氮的化合物广泛存在于自然界,是一类非常重要的化合物.回答下列有关问题:
(1)在一定条件下;2N2(g)+6H2O(g)=4NH3(g)+3O2(g)。已知该反应相关的化学键键能数据如表一:
表一:
化学键 | | H-O | N-H | O=O |
E/(kJ/mol) | 946 | 463 | 391 | 496 |
则该反应的△H=___________kJ/mol
(2)在恒容密闭容器中充入2 molNO2与1molO2发生反应如下:
4NO2(g)+O2(g)![]() 2N2O5(g)
2N2O5(g)
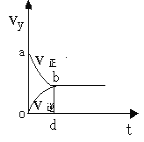
①已知在不同温度下测得N2O5的物质的量随时间的变化如图1所示.常温下,该反应能逆向自发进行,原因是____________________________________________。

②下列有关该反应的说法正确的是___________。
A.扩大容器体积,平衡向逆反应方向移动,混合气体颜色变深
B.恒温恒容,再充入2molNO2和1molO2,再次达到平衡时NO2转化率增大
C.恒温恒容,当容器内的密度不再改变,则反应达到平衡状态
D.若该反应的平衡常数增大,则一定是降低了温度
(3)N2O5是一种新型绿色硝化剂,其制备可以用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5,工作原理如图。则硼氢化钠燃料电池的负极反应式为______________________。
(4)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种。下表二是常温下浓度均为0.01mol/L的X、Y、Z、W溶液的pH。将X、Y、Z各lmol同时溶于水中得到混合溶液,则混合溶液中各离子的浓度由大到小的顺序为______________________。
0.01mol/L的溶液 | X | Y | Z | W |
pH | 12 | 2 | 8.5 | 4.5 |
(5)氮的氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
I: 2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
II: 2NO(g)+Cl2(g)![]() 2ClNO(g) K2
2ClNO(g) K2
①4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=___________(用K1、K2表示)
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=___________(用K1、K2表示)
②在恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.1molCl2,10min时反应Ⅱ达到平衡测得10min内v(ClNO)=7.5×10-3mol/(L·min),则平衡时NO的转化率α1=___________;其他条件不变,反应Ⅱ在恒压条件下进行,平衡时NO的转化率α2=___________α1 (填“>”“<”或“=”)
【答案】+1268 逆反应方向的△S>0 BD BH4-+8OH--8e-=BO2-+6H2O c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+) K12/K2 75% >
【解析】
(1)根据△H=反应物键能总和-生成物键能总和=(2×946kJ·mol-1+6×2×463kJ·mol-1-4×3×391kJ·mol-1-3×496kJ·mol-1)=+1268kJ·mol-1;
(2)①根据图像,II的温度高于I,升高温度,平衡向逆反应方向进行,即该反应的正反应方向△H<0,能够自发进行,△G=△H-T△S<0,常温下,该反应能逆向自发进行,原因是逆反应方向的△S>0;
②A、扩大容器的体积,气体压强减小,平衡向逆反应方向进行,但组分的浓度减小,混合气体颜色变浅,故A错误;
B、再充入2molNO2和1molO2,相当于增大压强,平衡向正反应方向进行,NO2的转化率增大,故B正确;
C、组分都是气体,即气体总质量不变,容器为恒容装置,气体体积不变,根据密度的定义,任何时刻,密度保持不变,因此密度不变,不能说明该反应达到平衡,故C错误;
D、该反应平衡常数增大,说明温度改变,根据①的分析,该反应为放热反应,因此该反应平衡常数增大,一定是降低温度,故D正确;
(3)BH4-中B为+3价,H为-1价,BO2-中B为|+3价,O为-2价,根据装置图,-1价H转变成+1价,根据原电池工作原理,通BH4-和OH-一极为负极,电极反应式为BH4-+8OH--8e-=BO2-+6H2O;
(4)浓度均为0.01mol·L-1,X溶液为碱性,且pH=12,推出X为NaOH,Y溶液显酸性,且pH=2,推出Y为HNO3,Z溶液显碱性,pH=8.5,推出Z为NaNO2,同理W为NH4NO3,X、Y、Z各1mol同时溶于水,NaOH和HNO3恰好完全反应,即混合溶液中的溶质为NaNO3和NaNO2,NaNO2为强碱弱酸盐,NO2-发生水解,溶液显碱性,即离子浓度大小顺序是c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+);
(5)①K1=c(ClNO)/c2(NO2),K2=c2(ClNO)/[c(Cl2)×c2(NO)],K=[c2(NO)×c(Cl2)]/c4(NO2),因此K=K12/K2;
②10min内生成ClCNO的物质的量为7.5×10-3mol/(L·min)×2L×10min=0.15mol,则消耗NO的物质的量为0.15mol,即NO的转化率为0.15/0.2×100%=75%;该反应是气体物质的量减少,反应II在恒压条件下,压强比恒容时大,向正反应方向进行趋势大,即恒压条件下,NO的转化率α2>α1。

【题目】氧化锌是一种常用添加剂,广泛应用于塑料、合成橡胶、电池等产品的制造。一种利用氧化锌烟灰制备活性氧化锌的工艺流程如下:
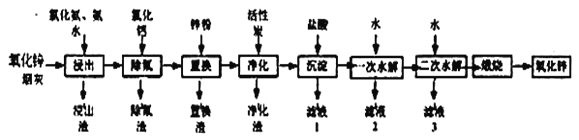
已知:I.氧化锌烟灰的主要化学组成如下:
元素组成 | Zn | Pb | Cu | Cl | F |
质量分数% | 59.78 | 9.07 | 0.30 | 2.24 | 1.80 |
Ⅱ.浸出”时,大部分锌元素以Zn(NH3)42+形式进入溶液,同时部分Pb、Cu、F元素也进入溶液中。
(1)氨的电子式______________________。
(2)“浸出”时,氧化锌发生反应的离子方程式为_________________________________;“浸出”时温度不宜过高,其原因为____________________________________________。
(3)若“浸出”后,所得溶液中c(F-)=0.02mol/L,向其中加入等体积的氯化钙溶液(忽略溶液体积变化),使F-沉淀完全即溶液中c(F-)<10-5mol/L,则所加氯化钙溶液的浓度度最小为___________。已知:Ksp(CaF2)=3.45×10-11
(4)“置换”时,所得置换渣中除了含Zn外,还含有___________;“净化”时,利用活性炭___________性,除去溶液中残留的有机物。
(5)“沉淀”时,可得到滤渣Zn(NH3)2Cl2。所加盐酸过量时,会导致沉淀部分溶解甚至消失,其化学方程式为____________________________________________。
(6)“一次水解”时,产物为Zn(OH)xCly。取10.64g该水解产物,经二次水解、煅烧后,可得活性氧化锌8.1g(假设各步均转化完全)。则一次水解产物的化学式为___________。
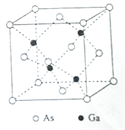
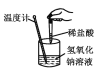
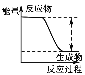
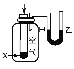
【题目】下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是
A | B | C | D | |
图示 |
|
|
|
|
相关 信息 | 温度计的水银柱不断上升 | 反应物总能量大于生成物总能量 | 反应开始后,甲处液面低于乙处液面 | 反应开始后,针筒活塞向右移动 |
A.AB.BC.CD.D