题目内容
【题目】(1)常温下,在200 mL氢氧化钡溶液中含有1×10-3mol的钡离子,将此溶液与pH=3的盐酸混合,使其混合溶液的pH=7,应取氢氧化钡溶液和盐酸的体积之比是_________。
(2)25℃时,利用pH试纸测得0.1molL-1醋酸溶液的pH约为3,则可以估算出醋酸的电离常数约为_______;向10mL此溶液中加入少量冰醋酸,忽略溶解过程中溶液温度和体积的微小变化,溶液中c(H+)/c(CH3COOH)的值将_____(填“增大”、“减小”或“无法确定”)。
(3)电化学法是合成氨的一种新方法,其原理如图所示,阴极的电极反应式是_____。

(4)废水中含氮化合物的处理方法有多种。
① NaClO溶液可将废水中的NH4+转化为N2。若处理过程中产生N2 0.672 L(标准状况),则需要消耗0.3 mol·L-1的NaClO溶液______________L。
②在微生物的作用下,NH4+经过两步反应会转化为NO3-,两步反应的能量变化如图所示。则1 mol NH4+(aq)全部被氧化成NO3-(aq)时放出的热量是______________kJ。
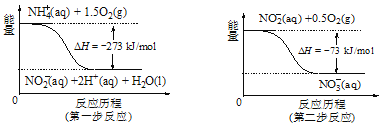
③ 用H2催化还原法可降低水中NO3-的浓度,得到的产物能参与大气循环,则反应后溶液的pH______(填“升高”、“降低”或“不变”)。
(5)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。若某次捕捉后得到pH=10 的溶液,则溶液c(CO32-)∶c(HCO3-)=_______。 [常温下K1(H2CO3)=4.4×10-7、 K2(H2CO3)=5×10-11]。
【答案】1:1010-5mol·L-1减小N2+6H++6e- = 2NH30.3346升高1:2或0.5
【解析】
(1)在Ba(OH)2溶液中,Ba2+和OH-的物质的量之比为1:2,故n(OH-)=2n(Ba2+)=2×10-3mol;pH=3的盐酸中c(H+)=10-3mol/L,设盐酸溶液的体积为V,根据混合后溶液显中性,则n(OH-)=n(H+),即2×10-3mol =10-3mol/L×V,解得V=2L=2000mL,故应取氢氧化钡溶液和盐酸的体积之比是200mL:2000mL=1:10;
(2)25℃时,利用pH试纸测得0.1molL-1醋酸溶液的pH约为3,弱电解质存在电离平衡,CH3COOHCH3COO-+H+,常数Ka=![]() ,醋酸溶液的pH约为3,氢离子和醋酸根离子浓度为10-3mol/L,溶液中醋酸溶质浓度近似为0.1mol/L,则可以估算出醋酸的电离常数约为
,醋酸溶液的pH约为3,氢离子和醋酸根离子浓度为10-3mol/L,溶液中醋酸溶质浓度近似为0.1mol/L,则可以估算出醋酸的电离常数约为![]() =10-5mol/L,向10mL此溶液中加入少量冰醋酸,溶解后醋酸溶液浓度增大,醋酸电离程度减小,
=10-5mol/L,向10mL此溶液中加入少量冰醋酸,溶解后醋酸溶液浓度增大,醋酸电离程度减小,![]() 比值减小;
比值减小;
(3) 根据氢离子移动方向可知,通入氢气端为阳极,通入氮气端为阴极,阴极上氮气得到电子生成氨气,电极反应式为N2+6H++6e- = 2NH3;
(4)①N失去电子,Cl得到电子,设消耗0.3molL-1的NaClO溶液为xL,由电子守恒可知,0.3mol×xL×2=![]() ×2×3,解得x=0.3;
×2×3,解得x=0.3;
②由图可知,第一步热化学反应为NH4+ (aq)+1.5O2(g)=2H+(aq)+NO2- (aq)+H2O(l)△H=-273 kJmol-1①,第二步热化学反应为NO2- (aq)+0.5O2(g)=NO3- (aq)△H=-73kJmol-1②,由盖斯定律可知①+②得1mol NH4+(aq)全部氧化成NO3- (aq)的热化学方程式为NH4+ (aq)+2O2(g)=2H+(aq)+NO3- (aq)+H2O(l)△H=-346 kJmol-1,即放出346kJ的热量;
③H2催化还原饮用水中NO3-,反应中的还原产物和氧化产物均可参与大气循环,则产物为水和氮气,该反应为5H2+2NO3-![]() N2+4H2O+2OH-,氢氧根离子浓度增大,则pH升高;
N2+4H2O+2OH-,氢氧根离子浓度增大,则pH升高;
(5)若某次捕捉后得到pH=10 的溶液,则溶液酸碱性主要决定CO32-+ H2O ![]() HCO3-+ OH-,K=
HCO3-+ OH-,K=![]() ,c(CO32-)∶c(HCO3-)=
,c(CO32-)∶c(HCO3-)=![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案