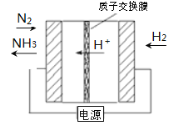
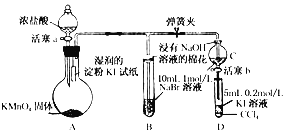
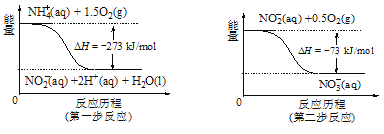题目内容
【题目】乙醇分子结构中,各化学键如图所示。关于乙醇在各种反应中断键的说法不正确的是( )
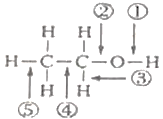
A. 和浓硫酸共热至170℃时,②、⑤键断裂 B. 和金属钠反应时,①键断裂
C. 在银催化条件下与O2反应时,①、③键断裂 D. 乙醇燃烧时,②、④键渐裂
【答案】D
【解析】分析:乙醇含有-OH,可发生取代、氧化和消去反应,可与钠反应,结合官能团的性质判断可能的共价键的断裂方式,以此解答。
详解:A.和浓硫酸共热至170℃时发生消去反应生成乙烯和水,②、⑤键断裂,A正确
B.乙醇与金属钠反应生成乙醇钠和氢气,断开的羟基上的氢氧键,即①断裂,B正确;
C.乙醇在银催化下与O2反应生成乙醛和水,断开的是羟基上的氢氧键和与羟基所连的碳的氢,即①③断裂,C正确;
D.燃烧生成二氧化碳和水,所有的化学键都断裂,D错误;答案选D。

练习册系列答案
 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目