题目内容
10.下表是不同温度下水的离子积常数:| 温度/℃ | 25 | T2 |
| 水的离子积常数 | 1×10-14 | 1×10-12 |
(1)T2℃时,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=9:11.此溶液中各种离子的浓度由大到小的顺序是c(Na+)>c(SO42-)>c(H+)>c(OH-).
(2)25℃时,用0.01mol/LNaOH溶液滴定0.02mol/L 的硫酸,中和后加蒸馏水稀释到5mL,若滴定时终点判断有误差;①多加了1滴NaOH溶液②少加1滴NaOH溶液(设1滴为0.05mL),则①和②溶液中c(OH-)之比是106:1.
(3)25℃时,0.1mol/L的NaHCO3溶液的pH为8,同浓度的NaAlO2溶液的pH为11.将两种溶液等体积混合,可能发生的现象白色沉淀其主要原因是(用离子方程式表示)AlO2-+HCO3-+H2O=Al(0H)3↓+CO32-.
(4)已知25℃时:
| 难溶物 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 |
| Ksp | 8.0×10-16 | 8.0×10-38 | 1.0×10-17 |
分析 (1)混合液的pH=2,酸过量,根据c(H+)=$\frac{n({H}^{+})-n(O{H}^{-})}{V}$,计算,根据反应后溶液的组成分析各种离子的浓度大小;
(2)①多加了1滴NaOH溶液,为碱溶液;②少加1滴NaOH溶液,为酸溶液;
(3)水解均显碱性,由pH的大小可知,等体积混合时AlO2-促进HCO3-的电离;
(4)铁加入稀H2SO4和H2O2,可被氧化生成Fe3+,铁刚好沉淀完全时离子浓度小于1×10-5mol•L-1,结合Ksp=10-39计算pH,并根据Ksp计算锌开始沉淀的pH.
解答 解:(1)混合液的pH=2,酸过量,c(H+)=c(H+)=$\frac{n({H}^{+})-n(O{H}^{-})}{V}$=$\frac{0.1{V}_{2}-0.1{V}_{1}}{{V}_{1}+{V}_{2}}$=0.01,
解之得:$\frac{{V}_{1}}{{V}_{2}}$=9:11,
c(Na+)=0.1×9/(9+11)=0.045mol/L
c(SO42-)=0.05×11/20=0.0275mol/L
c(H+)=0.01mol/L
硫酸过量溶液显酸性,c 则(H+)>c (OH-),
故溶液中各种离子的浓度由大到小的排列顺序是:c (Na+)>c (SO42-)>c (H+)>c (OH-),
故答案为:9:11;c(Na+)>c(SO42-)>c(H+)>c(OH-);
(2)①多加了1滴NaOH溶液,为碱溶液,c(OH-)=$\frac{0.05×0.01}{5}$=10-4mol/L;②少加1滴NaOH溶液,为酸溶液,c(H+)=$\frac{0.025×0.02×2}{5}$=10-4mol/L,c(OH-)=10-10mol/L,则①和②溶液中c(OH-)之比是106:1,故答案为:106:1;
(3)水解均显碱性,由pH的大小可知,等体积混合时AlO2-促进HCO3-的电离,发生AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-,观察到白色沉淀,
故答案为:白色沉淀;AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-;
(4)铁加入稀H2SO4和H2O2,可被氧化生成Fe3+,铁刚好沉淀完全时离子浓度小于1×10-5mol•L-1,因Ksp=10-39,
则c(OH-)=$\root{3}{\frac{1{0}^{-39}}{1×1{0}^{-5}}}$mol/L≈0.5×10-11mol/L,此时pH=2.7,
如锌开始沉淀,则c(OH-)=$\sqrt{\frac{1{0}^{-17}}{0.1}}$mol/L=10-8mol/L,此时pH=6,
由表中数据可知Zn(OH)2、Fe(OH)2的Ksp相近,如不加H2O2,则Zn2+和Fe2+分离不开,
故答案为:[2.7,6);Zn2+和Fe2+分离不开;Zn(OH)2、Fe(OH)2的Ksp相近.
点评 本题考查酸碱混合的pH的计算,计算量较大,涉及酸、碱、酸碱混合的pH计算,注意把握信息分析解答,题目难度中等.

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案| A | B | C | |
| D | E | F |
(1)写出甲的电子式
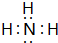 ,实验室制取气体甲的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O
,实验室制取气体甲的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O(2)B、C、G个数比为1:1:5形成的化合物的化学键类型为b.
a.离子键 b.极性键 c.非极性键
(3)请用电子式表示AE2的形成过程
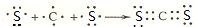 .
.(4)用离子符号表示C、E、F、H四种离子的半径由大到小的顺序S2->Cl->O2->Na+.
(5)用一个离子方程式解释A比D非金属性强的原因CO2+H2O+SiO32-=CO32-+H2SiO3↓.
| A. | 液态氯化氢 | B. | 盐酸 | C. | 酒精 | D. | 食盐晶体 |
| A. | H+ | B. | Fe3+ | C. | Na+ | D. | NO3- |
 (氧化剂)
(氧化剂)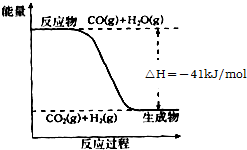 研究化学反应中的能量变化有重要意义.请根据学过知识回答下列问题:
研究化学反应中的能量变化有重要意义.请根据学过知识回答下列问题: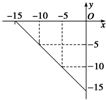 某温度下的溶液中,c(H+)=10x mol•L?1,c(OH-)=10y mol•L?1.x与y的关系如图所示:
某温度下的溶液中,c(H+)=10x mol•L?1,c(OH-)=10y mol•L?1.x与y的关系如图所示: