题目内容
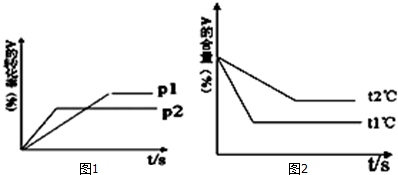
19. 某温度下的溶液中,c(H+)=10x mol•L?1,c(OH-)=10y mol•L?1.x与y的关系如图所示:
某温度下的溶液中,c(H+)=10x mol•L?1,c(OH-)=10y mol•L?1.x与y的关系如图所示:①该温度下,NaCl溶液的pH=7.5.
②该温度下,pH=8的Ba(OH)2溶液与pH=6的盐酸混合,并保持恒温,欲使混合溶液的pH=7,则Ba(OH)2溶液与盐酸的体积比为9:2.(忽略溶液混合时体积变化)
分析 ①图中数据计算离子积常数=c(H+).c(OH-),根据离子积常数计算氢离子浓度,进而求pH;
②设出氢氧化钡溶液、盐酸溶液的体积,然后根据溶液的pH列式计算出二者的体积比.
解答 解:①根据图知,当c(H+)=10-5 mol/L,c(OH-)=10-10 mol/L,由离子积常数=c(H+).c(OH-)=10-5×10-10=10-15,
中性溶液中,c(H+)=c(OH-)=$\sqrt{1{0}^{-15}}$=10-7.5,pH=-lg10-7.5=7.5,
故答案为:7.5;
②设氢氧化钡容溶液的体积为xL,盐酸的体积为y,pH=8的Ba(OH)2溶液,溶液中c(OH-)=1×10-7mol/L,
pH=6的稀盐酸溶液中c(H+)=1×10-6mol/L,
欲使混合溶液pH=7<7.5,溶液此时显酸性,即混合后c(H+)=1×10-7mol/L,即$\frac{1{0}^{-6}y-1{0}^{-7}x}{x+y}$=1×10-5mol/L,解得x:y=9:2,
故答案为:9:2.
点评 本题考查了水的电离平衡分析,离子积常数的计算应用,注意离子积是一定温度下的常数,随温度改变,掌握基础是关键,题目难度中等.

练习册系列答案
 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
9.下列叙述不正确的是( )
| A. | 常温下,10mL0.02 mol•L-1 HCl溶液与10mL0.02 mol•L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=11 | |
| B. | 在0.1 mol•L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+) | |
| C. | 中和物质的量浓度与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 | |
| D. | 配制三氯化铁溶液时应将三氯化铁溶于浓盐酸,再加水稀释至所需浓度 |
10.下表是不同温度下水的离子积常数:
试回答以下问题:
(1)T2℃时,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=9:11.此溶液中各种离子的浓度由大到小的顺序是c(Na+)>c(SO42-)>c(H+)>c(OH-).
(2)25℃时,用0.01mol/LNaOH溶液滴定0.02mol/L 的硫酸,中和后加蒸馏水稀释到5mL,若滴定时终点判断有误差;①多加了1滴NaOH溶液②少加1滴NaOH溶液(设1滴为0.05mL),则①和②溶液中c(OH-)之比是106:1.
(3)25℃时,0.1mol/L的NaHCO3溶液的pH为8,同浓度的NaAlO2溶液的pH为11.将两种溶液等体积混合,可能发生的现象白色沉淀其主要原因是(用离子方程式表示)AlO2-+HCO3-+H2O=Al(0H)3↓+CO32-.
(4)已知25℃时:
用废电池的锌皮制备ZnSO4•7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解.当加碱调节pH为[2.7,6)时,铁刚好完全沉淀而锌开始沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全;假定Zn2+浓度为0.1mol/L).若上述过程不加H2O2后果和原因是Zn2+和Fe2+分离不开,Fe(OH)2和Zn(OH)2的Ksp相近.(lg2=0.3 lg3=0.48)
| 温度/℃ | 25 | T2 |
| 水的离子积常数 | 1×10-14 | 1×10-12 |
(1)T2℃时,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=9:11.此溶液中各种离子的浓度由大到小的顺序是c(Na+)>c(SO42-)>c(H+)>c(OH-).
(2)25℃时,用0.01mol/LNaOH溶液滴定0.02mol/L 的硫酸,中和后加蒸馏水稀释到5mL,若滴定时终点判断有误差;①多加了1滴NaOH溶液②少加1滴NaOH溶液(设1滴为0.05mL),则①和②溶液中c(OH-)之比是106:1.
(3)25℃时,0.1mol/L的NaHCO3溶液的pH为8,同浓度的NaAlO2溶液的pH为11.将两种溶液等体积混合,可能发生的现象白色沉淀其主要原因是(用离子方程式表示)AlO2-+HCO3-+H2O=Al(0H)3↓+CO32-.
(4)已知25℃时:
| 难溶物 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 |
| Ksp | 8.0×10-16 | 8.0×10-38 | 1.0×10-17 |
7.36.5gHCl溶解在1L水中(水的密度近似为1g•mL-1),所得溶液的密度为ρg•mL-1,质量分数为w,物质的量浓度为cmol•L-1,NA表示阿伏加德罗常数,则下列叙述正确的是( )
| A. | 所得溶液的质量分数:w=36.5c/1000 | |
| B. | 36.5 gHCl气体在标准状况下占有的体积约为22.4L | |
| C. | 所得溶液的物质的量浓度:c=1 mol•L-1 | |
| D. | 所得溶液中含有NA个HCl分子 |
4.下列说法正确的是( )
| A. | NaCl溶于水在电流作用下电离成钠离子和氯离子 | |
| B. | 电离时生成的阳离子全部是H+的化合物叫做酸 | |
| C. | CO2的水溶液能导电,所以CO2是电解质 | |
| D. | 固体NaCl不导电,液态氯化氢能导电 |
8.已知某溶液中只存在OH-、H+、Na+、CH3COO-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
(1)这四组关系中有一组是不可能的,这组关系是B(选填序号).
(2)若该溶液只有一种溶质,上述离子浓度大小顺序关系中正确的是(选填序号)D.
| A.c (CH3COO-)>c (Na+)>c (H+)>c (OH-) | B.c (CH3COO-)>c (Na+)>c (OH-)>c (H+) |
| C.c (CH3COO-)>c (H+)>c (Na+)>c (OH-) | D.c (Na+)>c(CH3COO-)>c (OH-)>c (H+) |
(2)若该溶液只有一种溶质,上述离子浓度大小顺序关系中正确的是(选填序号)D.