��Ŀ����
����Ŀ���о�С������ú��ȵ��л���A�ϳ���֯�����̿���������M��·������(���ַ�Ӧ�Լ�������δע��)��
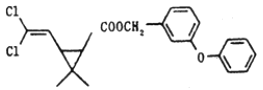
��֪����E�ķ���ʽΪC5H8O4���ܷ���ˮ�ⷴӦ���˴Ź���������ʾE��������2�ֲ�ͬ��ѧ��������ԭ�ӣ��������Ϊ3��1��
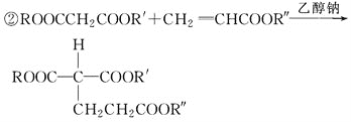
(R��R�䡢R�������ͬ����ͬ������)��
(1)A�����еĺ��������ŵ�������________________��
(2)D��E��Ӧ�Ļ�ѧ����ʽ��____________��
(3)A��B��Ӧ������Լ���________________��
(4)G��H��Ӧ�Ļ�ѧ����ʽ��____________��
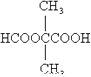
(5)��֪1 mol E��2 mol J��Ӧ����1 mol M����M�Ľṹ��ʽ��________��
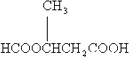
(6)E��ͬ���칹�����������ʣ�������NaHCO3��Ӧ����CO2�����ܷ���ˮ�ⷴӦ����ˮ�����֮һ�ܷ���������Ӧ�����ͬ���칹�干��________�֣���������1�ֵĽṹ��ʽ��________��
(7)J�ɺϳɸ߷��ӻ�����ø߷��ӻ�����Ľṹ��ʽ��________��
���𰸡��ǻ�HOOCCH2COOH��2CH3OH![]() CH3OOCCH2COOCH3��2H2ONaOHˮ��ҺClCH2CH2COOH��2NaOH
CH3OOCCH2COOCH3��2H2ONaOHˮ��ҺClCH2CH2COOH��2NaOH![]() CH2===CHCOONa��NaCl��2H2O
CH2===CHCOONa��NaCl��2H2O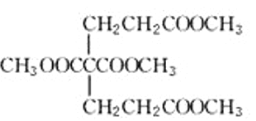 5
5
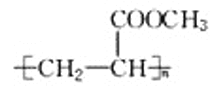
��������
E�ķ���ʽΪC5H8O4���ܷ���ˮ�ⷴӦ�����������������Ͷ�Ϊ![]() =2���˴Ź���������ʾE��������2�ֲ�ͬ��������ԭ�ӣ��������Ϊ3��1��Hԭ����Ŀ�ֱ�Ϊ6��2��E������Ӧ����2��������2��-CH3��1��-CH2-����E�Ľṹ��ʽΪCH3OOCCH2COOCH3��C��������Һ��Ӧ���ữ�õ�D��Dת���õ�E����DΪ���ᡢCΪȩ����DΪHOOCCH2COOH����BӦ��HOCH2CH2CH2OH��A�Ǻ��ȵ��л����Cu��������������������F����������Һ��Ӧ���ữ�õ�G����A�л������ǻ�-OH����AΪClCH2CH2CH2OH��˳�ƿɵã�FΪClCH2CH2CHO��GΪClCH2CH2COOH��E��J������Ϣ�з�Ӧ����HΪCH2�TCHCOOH��JΪCH2�TCHCOOCH3��1molE��2molJ��Ӧ����1molM����MΪ
=2���˴Ź���������ʾE��������2�ֲ�ͬ��������ԭ�ӣ��������Ϊ3��1��Hԭ����Ŀ�ֱ�Ϊ6��2��E������Ӧ����2��������2��-CH3��1��-CH2-����E�Ľṹ��ʽΪCH3OOCCH2COOCH3��C��������Һ��Ӧ���ữ�õ�D��Dת���õ�E����DΪ���ᡢCΪȩ����DΪHOOCCH2COOH����BӦ��HOCH2CH2CH2OH��A�Ǻ��ȵ��л����Cu��������������������F����������Һ��Ӧ���ữ�õ�G����A�л������ǻ�-OH����AΪClCH2CH2CH2OH��˳�ƿɵã�FΪClCH2CH2CHO��GΪClCH2CH2COOH��E��J������Ϣ�з�Ӧ����HΪCH2�TCHCOOH��JΪCH2�TCHCOOCH3��1molE��2molJ��Ӧ����1molM����MΪ ���ݴ˽����
���ݴ˽����
E�ķ���ʽΪC5H8O4C���ܷ���ˮ�ⷴӦ�����������������Ͷ�Ϊ![]() =2���˴Ź���������ʾE��������2�ֲ�ͬ��������ԭ�ӣ��������Ϊ3��1��Hԭ����Ŀ�ֱ�Ϊ6��2��E������Ӧ����2��������2��-CH3��1��-CH2-����E�Ľṹ��ʽΪCH3OOCCH2COOCH3��C��������Һ��Ӧ���ữ�õ�D��Dת���õ�E����DΪ���ᡢCΪȩ����DΪHOOCCH2COOH����BӦ��HOCH2CH2CH2OH��A�Ǻ��ȵ��л����Cu��������������������F����������Һ��Ӧ���ữ�õ�G����A�л������ǻ�-OH����AΪClCH2CH2CH2OH��˳�ƿɵã�FΪClCH2CH2CHO��GΪClCH2CH2COOH��E��J������Ϣ�з�Ӧ����HΪCH2�TCHCOOH��JΪCH2�TCHCOOCH3��������Ϣ��֪��1molE��2molJ��Ӧ����1molM����MΪ
=2���˴Ź���������ʾE��������2�ֲ�ͬ��������ԭ�ӣ��������Ϊ3��1��Hԭ����Ŀ�ֱ�Ϊ6��2��E������Ӧ����2��������2��-CH3��1��-CH2-����E�Ľṹ��ʽΪCH3OOCCH2COOCH3��C��������Һ��Ӧ���ữ�õ�D��Dת���õ�E����DΪ���ᡢCΪȩ����DΪHOOCCH2COOH����BӦ��HOCH2CH2CH2OH��A�Ǻ��ȵ��л����Cu��������������������F����������Һ��Ӧ���ữ�õ�G����A�л������ǻ�-OH����AΪClCH2CH2CH2OH��˳�ƿɵã�FΪClCH2CH2CHO��GΪClCH2CH2COOH��E��J������Ϣ�з�Ӧ����HΪCH2�TCHCOOH��JΪCH2�TCHCOOCH3��������Ϣ��֪��1molE��2molJ��Ӧ����1molM����MΪ ��
��
��1�������Ϸ�����֪��AΪClCH2CH2CH2OH��A���ӿ��Ա�������Ϊȩ�࣬���Ժ��д��ǻ�����˱���������ǻ���
��2�������Ϸ�����֪��DΪHOOCCH2COOH����״���Ӧ����������Ӧ����ʽ��HOOCCH2COOH��2CH3OH![]() CH3OOCCH2COOCH3��2H2O������������������ǣ�HOOCCH2COOH��2CH3OH
CH3OOCCH2COOCH3��2H2O������������������ǣ�HOOCCH2COOH��2CH3OH![]() CH3OOCCH2COOCH3��2H2O��
CH3OOCCH2COOCH3��2H2O��
��3��A��B��ClCH2CH2CH2OH��NaOHˮ��Һ�����������·���ˮ�ⷴӦ����HOCH2CH2CH2OH���������������������NaOHˮ��Һ��������
��4��G��H��ClCH2CH2COOH���������ƴ���Һ�����������·�����ȥ��Ӧ����CH2�TCHCOOH����Ӧ����ʽΪ��ClCH2CH2COOH��2NaOH![]() CH2===CHCOONa��NaCl��2H2O������������������ǣ�ClCH2CH2COOH��2NaOH
CH2===CHCOONa��NaCl��2H2O������������������ǣ�ClCH2CH2COOH��2NaOH![]() CH2===CHCOONa��NaCl��2H2O��
CH2===CHCOONa��NaCl��2H2O��
 ���������������������
��������������������� ��
����6��CH3OOCCH2COOCH3��ͬ���칹�����������ʣ�������NaHCO3��Ӧ����CO2������-COOH�����ܷ���ˮ�ⷴӦ����ˮ�����֮һ�ܷ���������Ӧ��Ϊ�����γɵ���������-OOCH������������ͬ���칹���У�![]() ��
��![]() ��
��![]() ��
�� ��
�� ���ʹ���5�����������������������5��
���ʹ���5�����������������������5��![]() ��
��![]() ��
��![]() ��
�� ��
�� �е�����һ����
�е�����һ����
��7��CH2=CHCOOCH3�к���˫�������Է����Ӿ۷�Ӧ�����ɸ߾���![]() ���������������������
���������������������![]() ��
��

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ���״���һ�ֿ�������Դ���ɶ�����̼�Ʊ��״��Ĺ��̿����漰�ķ�Ӧ���£�
��Ӧ��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ��H1=-49.58kJ��mol-1
CH3OH(g)+H2O(g) ��H1=-49.58kJ��mol-1
��Ӧ��CO2(g)+H2(g)![]() CO(g)+H2O(g) ��H2
CO(g)+H2O(g) ��H2
��Ӧ��CO(g)+2H2(g)![]() CH3OH(g) ��H3=-90.77kJ��mol-1
CH3OH(g) ��H3=-90.77kJ��mol-1
�ش��������⣺
��1����Ӧ��ġ�H2=_________________��
��2����Ӧ���ܹ��Է����е�������_______________ (�����ϵ��¶��� ���ϸ��¶��������κ��¶��� )��
��3�����£������ܱ������У����ڷ�Ӧ������˵������˵���÷�Ӧ�ﵽ��ѧƽ��״̬����______��
A�����������ܶȲ��ٱ仯
B����������ƽ����Է����������ٱ仯
C��CO2��H2��CH3OH��H2O�����ʵ���֮��Ϊ1��3��1��1
D���״��İٷֺ������ٱ仯
��4�����ڷ�Ӧ��ͬ�¶ȶ�CO2��ת���ʼ�������Ч��Ӱ����ͼ��ʾ�������й�˵������ȷ����__________��
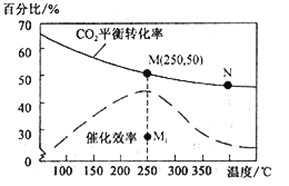
A�������������䣬����ʹ�ô�������250��ʱCO2��ƽ��ת���ʿ���λ��M1
B���¶ȵ���250 ��ʱ�����¶����״��IJ�������
C��M ��ʱƽ�ⳣ����N��ʱƽ�ⳣ����
D��ʵ�ʷ�ӦӦ�������ڽϵ͵��¶��½��У������CO2��ת����
��5����֪����������20���µ�Ksp���£��Իش��������⣺
��� | �� | �� | �� | �� | �� |
��ѧʽ | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
��ɫ | ��ɫ | dz��ɫ | ��ɫ | ��ɫ | ��ɫ |
Ksp | 1.8��10-10 | 5.4��10-13 | 8.3��10-17 | 6.3��10-50 | 2.0��10-12 |
��20��ʱ�������������α�����Һ�У�Ag+���ʵ���Ũ���ɴ�С��˳���ǣ����ţ�____________��
����BaCl2��Һ�м���AgNO3��KBr�������ֳ�������ʱc(Br-)/c(Cl-)=________________��
�� �ⶨˮ�����Ȼ���ĺ��������ñ������������еζ����ζ�ʱ��Ӧ�����ָʾ����____��
A.KBr B��KI C��K2S D��K2CrO4
��6����֪25��ʱKsp[Mg(OH)2]=5.6��10-12��Ksp[Cu(OH)2]=2.2��10-20��Ksp[Fe(OH)3]=4.0��10-38��Ksp[Al(OH)3]=1.1��10-33��
����25���£���Ũ�Ⱦ�Ϊ0.1 mol��L-1��AlCl3��CuCl2�����Һ����μ��백ˮ��������______________����(�ѧʽ)��
����Һ��ij�������ʵ���Ũ�ȵ���1.0��10-5 mol��L-1ʱ������Ϊ�ѳ�����ȫ������һ��Ũ�ȵ�AlCl3��FeCl3�Ļ����Һ����μ��백ˮ����Fe3+�պ���ȫ����ʱ���ⶨc(Al3+)=0.2mol��L-1����ʱ���ó�����___________(������������������������)Al(OH)3��