题目内容
工业常用高温分解FeSO4的方法制备Fe2O3,其化学方程式为:
2FeSO4
Fe2O3+SO2↑+SO3↑
为检验FeSO4高温分解的产物,进行如下实验:
(1)取少量分解后的固体加入稀盐酸溶解,为了检验溶液中是否有Fe3+,还需要向溶液中加入______溶液,如有______现象则证明有Fe3+.
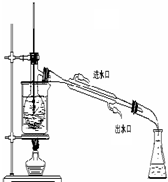
(2)将分解产生的气体通入下图所示的装置中:
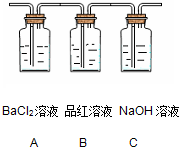
请回答下列问题:
如在装置______中,发现有______现象,则证明有SO3;
如在装置______中,发现有______现象则证明有SO2.
(3)装置中的NaOH溶液的作用是______.
请写出相应反应的离子方程式______.
2FeSO4
| ||
为检验FeSO4高温分解的产物,进行如下实验:
(1)取少量分解后的固体加入稀盐酸溶解,为了检验溶液中是否有Fe3+,还需要向溶液中加入______溶液,如有______现象则证明有Fe3+.
(2)将分解产生的气体通入下图所示的装置中:

请回答下列问题:
如在装置______中,发现有______现象,则证明有SO3;
如在装置______中,发现有______现象则证明有SO2.
(3)装置中的NaOH溶液的作用是______.
请写出相应反应的离子方程式______.
(1)检验铁离子,通常使用硫氰化钾溶液,为了检验溶液中是否有Fe3+,还需要向溶液中加入硫氰化钾溶液,如果溶液变红色,证明存在铁离子,
故答案为:硫氰化钾;溶液变红色;
(2)若装置A中的氯化钡溶液生成白色沉淀,证明分解产物中有三氧化硫;若装置B中品红溶液褪色,证明分解产物中含有二氧化硫,
故答案为:A;白色沉淀;B;品红溶液褪色;
(3)用于二氧化硫会污染大气,需要使用尾气吸收装置,氢氧化钠溶液能够与二氧化硫反应,可以除去多余的二氧化硫,反应的离子方程式为:2OH-+SO2=H2O+SO32-,
故答案为:除去多余的SO2,防止污染空气;2OH-+SO2=H2O+SO32-.
故答案为:硫氰化钾;溶液变红色;
(2)若装置A中的氯化钡溶液生成白色沉淀,证明分解产物中有三氧化硫;若装置B中品红溶液褪色,证明分解产物中含有二氧化硫,
故答案为:A;白色沉淀;B;品红溶液褪色;
(3)用于二氧化硫会污染大气,需要使用尾气吸收装置,氢氧化钠溶液能够与二氧化硫反应,可以除去多余的二氧化硫,反应的离子方程式为:2OH-+SO2=H2O+SO32-,
故答案为:除去多余的SO2,防止污染空气;2OH-+SO2=H2O+SO32-.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目