题目内容
利用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的Ca(NO3)2,其部分工艺流程如下:
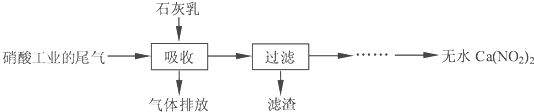
(1)硝酸工业尾气一般用碱液吸收,写出一个吸收尾气离子方程式______.
(2)上述工艺中采用气液逆流接触吸收(尾气从吸收塔底部进入,石灰乳从吸收塔顶部喷淋),其目的是______;滤渣可循环利用,滤渣的主要成分是______(填化学式).
(3)该工艺需控制NO和NO2物质的量之比接近1:1.若n(NO):n(NO)>1:1,则会导致______;若n(NO):n(NO)<1:1,则会导致______.
(4)生产中溶液需保持弱碱性,在酸性溶液中Ca(NO3)2会发生分解,产物之一是NO,其反应的离子方程式______.

(1)硝酸工业尾气一般用碱液吸收,写出一个吸收尾气离子方程式______.
(2)上述工艺中采用气液逆流接触吸收(尾气从吸收塔底部进入,石灰乳从吸收塔顶部喷淋),其目的是______;滤渣可循环利用,滤渣的主要成分是______(填化学式).
(3)该工艺需控制NO和NO2物质的量之比接近1:1.若n(NO):n(NO)>1:1,则会导致______;若n(NO):n(NO)<1:1,则会导致______.
(4)生产中溶液需保持弱碱性,在酸性溶液中Ca(NO3)2会发生分解,产物之一是NO,其反应的离子方程式______.
(1)硝酸工业尾气一氧化氮、二氧化氮一般用碱液吸收,反应为:NO+NO2+2OH-=2NO2-+H2O、2NO2+2OH-=NO2-+NO3-+H2O,
故答案为:NO+NO2+2OH-=2NO2-+H2O或2NO2+2OH-=NO2-+NO3-+H2O;
(2)使尾气中NO、NO2与石灰乳充分接触,NO、NO2被充分吸收;滤渣主要成分是Ca(OH)2,故答案为:使尾气中NO、NO2被充分吸收;Ca(OH)2;
(3)若n(NO):n(NO2)>1:1,则一氧化氮过量,排放气体中NO含量升高;若n(NO):n(NO2)<1:1,则二氧化氮过量,二氧化氮可与石灰乳反应生成Ca(NO3)2,故答案为:排放气体中NO含量升高;产品Ca(NO2)2中Ca(NO3)2含量升高;
(4)反应物是NO2-和H+,生成物是一氧化氮,硝酸根和水,反应的离子方程式为3NO2-+2H+=NO3-+2NO↑+H2O,故答案为:3NO2-+2H+=NO3-+2NO↑+H2O.
故答案为:NO+NO2+2OH-=2NO2-+H2O或2NO2+2OH-=NO2-+NO3-+H2O;
(2)使尾气中NO、NO2与石灰乳充分接触,NO、NO2被充分吸收;滤渣主要成分是Ca(OH)2,故答案为:使尾气中NO、NO2被充分吸收;Ca(OH)2;
(3)若n(NO):n(NO2)>1:1,则一氧化氮过量,排放气体中NO含量升高;若n(NO):n(NO2)<1:1,则二氧化氮过量,二氧化氮可与石灰乳反应生成Ca(NO3)2,故答案为:排放气体中NO含量升高;产品Ca(NO2)2中Ca(NO3)2含量升高;
(4)反应物是NO2-和H+,生成物是一氧化氮,硝酸根和水,反应的离子方程式为3NO2-+2H+=NO3-+2NO↑+H2O,故答案为:3NO2-+2H+=NO3-+2NO↑+H2O.

练习册系列答案
相关题目