题目内容
13.在隔绝空气的情况下,9.2g铁、镁、铝混合物溶解在一定量某浓度的稀硝酸中,当金属完全溶解后收集到4.48L(标准状况下)NO气体.在反应后的溶液中加入足量的烧碱溶液,可生成氢氧化物沉淀的质量为( )| A. | 18.6 g | B. | 20 g | C. | 19.4 g | D. | 24 g |
分析 根据n=$\frac{V}{{V}_{m}}$计算出反应生成NO的物质的量,然后根据硝酸与金属反应生成一氧化氮中化合价变化计算出转移电子的物质的量;
金属在反应中的转化关系为:M→Mn+→M(OH)n,再结合电子守恒可知,金属失去电子的物质的量等于硝酸中N原子得到电子的物质的量,也等于生成沉淀时结合OH-的物质的量,据此可以计算出最多生成沉淀的质量=金属质量+净增OH-的质量,由于沉淀中没有氢氧化铝,所以生成沉淀的质量小于该沉淀的最大值.
解答 解:硝酸与金属反应生成一氧化氮:HNO3→NO,化合价降低3价,得到3e-电子,标况下4.48LNO的物质的量为:n(NO)=$\frac{4.48L}{22.4L/mol}$=0.2mol,得到电子的物质的量为:n(e-)=3e-×0.2mol=0.6mol,
根据金属的转化关系:M→Mn+→M(OH)n和电子守恒可知,金属失去电子的物质的量等于硝酸中N原子得到电子的物质的量,也等于生成沉淀时结合OH-的物质的量,即:n(OH-)=n(e-)=0.6mol,
则最多生成沉淀的质量为:金属质量+净增OH-的质量=9.2g+0.6mol×17g/mol=19.4g,
由于沉淀中没有氢氧化铝,所以生成沉淀的质量小于19.4g,
故选A.
点评 本题考查混合物的有关计算,题目难度中等,解题关键是正确判断金属提供的电子的物质的量与氢氧根的物质的量之间的关系,要求学生明确守恒思想运用方法.

练习册系列答案
相关题目
3.对于如图所示铜-锌原电池,以下说法不正确的是( )
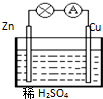

| A. | 铜为正极 | |
| B. | 它是一种把化学能转化为电能的装置 | |
| C. | 锌片上发生氧化反应 | |
| D. | 铜片向外电路提供电子,锌片从外电路得到电子 |
8.下列反应属于吸热反应的是( )
| A. | 钠与水反应 | B. | 镁带在空气中燃烧 | ||
| C. | 碳酸钙高温分解 | D. | 硝酸与氢氧化钠反应 |
18.在一定条件下,在密闭容器中进行的反应aX(g)+bY(g)?cZ(g)+dW(g),5min后达到平衡,X减少n mol•L-1,Y减少n/3mol•L-1,Z增加2n/3mol•L-1.在其他条件不变时,将容器体积增大,W的百分含量不发生变化.则化学方程式中各物质的化学计量数之比
a:b:c:d应为( )
a:b:c:d应为( )
| A. | 1:3:1:2 | B. | 3:1:2:2 | C. | 3:1:2:1 | D. | 1:3:2:2 |
2.关于氢键,下列说法正确的是( )
| A. | H2O是一种非常稳定的化合物,这是由于氢键所致 | |
| B. | 氯化钠易溶于水是因为形成了氢键 | |
| C. | 氨易液化与氨分子间存在氢键无关 | |
| D. | 甲硫醇(CH3SH)比甲醇的熔点低的原因是甲醇分子间易形成氢键 |
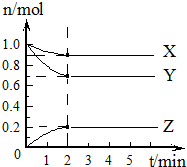 (1)某温度下,在一个2L密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如右图所示.
(1)某温度下,在一个2L密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如右图所示.