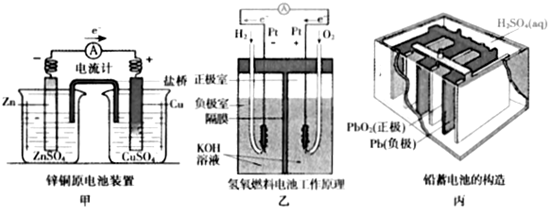
题目内容
3.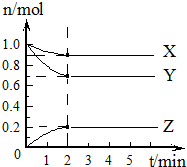 (1)某温度下,在一个2L密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如右图所示.
(1)某温度下,在一个2L密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如右图所示.分析有关数据,写出X、Y、Z反应的化学方程式:X+3Y?2Z.2min时Y的平均反应速率为0.075mol/(L•min).
(2)某温度下,在另一密闭容器中充入2molX和3molY,然后按(1)中的化学方程式进行反应,当达到化学平衡时,测得Z的物质的量分数为25%,则平衡时X的转化率为25%.
分析 (1)由图象可知,X、Y、Z同在2min内物质的量的变化量,其比值等于化学反应速率之比,也等于化学计量数之比;
2min时Y的平均反应速率=$\frac{\frac{△n}{V}}{△t}$;
(2)由(1)可知,反应为X+3Y?2Z,
开始 2 3 0
转化 x 3x 2x
平衡 2-x 3-3x 2x
平衡时,测得Z的物质的量分数为25%,则$\frac{2x}{2-x+3-3x+2x}$×100%=25%,以此计算转化率.
解答 解:(1)由图象可知,X、Y、Z同在2min内物质的量的变化量之比为(1-0.9):(1-0.7):(0.2-0)=1:3:2,其比值等于化学反应速率之比,也等于化学计量数之比,且由图象可知,2min达到平衡,则该反应为X+3Y?2Z,
2min时Y的平均反应速率=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{1-0.7}{2}}{2}$=0.075mol/(L•min);
故答案为:X+3Y?2Z;0.075mol/(L•min);
(2)由(1)可知,反应为X+3Y?2Z,
开始 2 3 0
转化 x 3x 2x
平衡 2-x 3-3x 2x
平衡时,测得Z的物质的量分数为25%,则$\frac{2x}{2-x+3-3x+2x}$×100%=25%,解得x=0.5mol,则X的转化率为$\frac{0.5mol}{2mol}$×100%=25%,故答案为:25%.
点评 本题考查化学平衡的计算,明确图象得到化学反应方程式是解答的关键,注意化学平衡三段法计算及平衡的判断,题目难度中等.

练习册系列答案
相关题目
13.在隔绝空气的情况下,9.2g铁、镁、铝混合物溶解在一定量某浓度的稀硝酸中,当金属完全溶解后收集到4.48L(标准状况下)NO气体.在反应后的溶液中加入足量的烧碱溶液,可生成氢氧化物沉淀的质量为( )
| A. | 18.6 g | B. | 20 g | C. | 19.4 g | D. | 24 g |
14.NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,4.4 g二氧化碳中所含碳原子数为0.1 NA | |
| B. | 标准状况下,11.2 L H2O中所含氧原子数为0.5 NA | |
| C. | 100mL 1mol/L的氯化铝溶液中所含氯离子数为0.1 NA | |
| D. | 实验室用H2O2制O2,每产生标准状况下11.2 L O2,转移的电子数为2 NA |
18.一定温度下,在一个固定容积的密闭容器里发生N2(g)+3H2(g)?2NH3(g)反应,此反应达到化学平衡状态的标志是:①N2,H2和NH3的浓度不再改变,②v正(NH3)=2v逆(N2),③c(N2):c(H2):c(NH3)=1:3:2,④单位时间里每增加1molN2,同时增加3molH2( )
| A. | ①②③④ | B. | ①②③ | C. | ①②④ | D. | 只有①② |
8.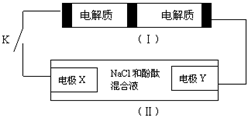 下图装置Ⅰ是一种可充电电池,装置Ⅱ为电解池.装置Ⅰ的离子交换膜只允许Na+通过,已知电池充放电的化学方程式为:
下图装置Ⅰ是一种可充电电池,装置Ⅱ为电解池.装置Ⅰ的离子交换膜只允许Na+通过,已知电池充放电的化学方程式为:
2Na2S2+NaBr3化气 $?_{充电}^{放电}$ Na2S4+3NaBr
当闭合开关K时,X电极附近溶液变红.下列说法正确的是( )
 下图装置Ⅰ是一种可充电电池,装置Ⅱ为电解池.装置Ⅰ的离子交换膜只允许Na+通过,已知电池充放电的化学方程式为:
下图装置Ⅰ是一种可充电电池,装置Ⅱ为电解池.装置Ⅰ的离子交换膜只允许Na+通过,已知电池充放电的化学方程式为:2Na2S2+NaBr3化气 $?_{充电}^{放电}$ Na2S4+3NaBr
当闭合开关K时,X电极附近溶液变红.下列说法正确的是( )
| A. | 闭合开关K时,钠离子从右到左通过离子交换膜 | |
| B. | 闭合开关K时,负极反应式为:3NaBr-2e-═NaBr3+2Na+ | |
| C. | 闭合开关K时,X电极反应式为:2Cl--2e-═Cl2↑ | |
| D. | 闭合开关K时,当有0.1molNa+通过离子交换膜,X电极上析出标准状况下气体1.12L |
2.日本福岛核电站的核原料铀-235(92235U)裂变释放出碘-131(53131I)和铯-137(55137Cs),关于它们的说法正确的是( )
| A. | 铀-235和碘-131是同位素 | B. | 碘-131的质子数为131 | ||
| C. | 铀-235的中子数是143 | D. | 碘-131和铯-137是同种元素 |