题目内容
【题目】工业用强氧化剂PbO2来制备KClO4的工业流程如下:
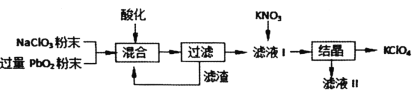
根据流程推测,下列判断不正确的是( )
A.“酸化”的试剂是稀硝酸或浓盐酸
B.“滤渣”主要成分是PbO2粉末,可循环使用
C.NaClO3与PbO2反应的离子方程式为![]()
D.在KNO3、KClO4、NaClO4、NaNO3中,常温下溶解度小的是KClO4
【答案】A
【解析】
工业用PbO2来制备KClO4,是在酸性条件下用PbO2将NaClO3氧化成NaClO4,过滤得含有NaClO4的溶液中加入硝酸钾,经结晶可得KClO晶体,
A.浓盐酸具有还原性会与NaClO3发生归中反应,同时也会消耗PbO2,故A错误;
B. “滤渣”主要成分是PbO2粉末,可循环使用,B正确;
C.根据产物可知NaClO3被PbO2氧化,根据电子守恒和元素守恒可知离子方程式为:![]() ,故C正确;
,故C正确;
D. 根据溶液中溶解度小的物质先析出,结合复分解反应的条件可判断溶解度较小的物质为KClO4,故D正确;
故答案为A。

练习册系列答案
相关题目