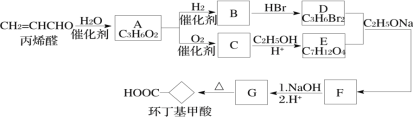
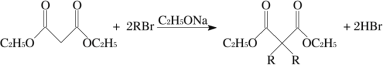
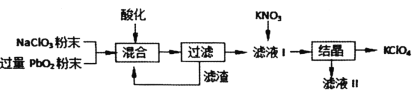
题目内容
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是( )
A.46 g C2H6O中含有的C-H键数一定为5NA
B.常温常压下,17g甲基(-14CH3)所含电子总数为9NA
C.标准状况下,11.2 L CO2和乙炔的混合气体所含![]() 键数目为NA
键数目为NA
D.CO2气体与足量的Na2O2反应,固体增重28g时转移了NA个电子
【答案】A
【解析】
A. 46 g C2H6O的物质的量n(C2H6O)=46 g ÷ 46 g/mol=1 mol,而C2H6O表示的物质可能为乙醇,也可能为二甲醚,当为二甲醚时,1 mol C2H6O含6 molC-H键,A错误;
B.—14CH3的摩尔质量为17 g/mol,1个甲基中含有9个电子,17 g甲基(—14CH3)的物质的量n(—14CH3)=17g ÷ 17 g/mol=1 mol,所以1 mol甲基含9 mol电子,B正确;
C. 标况下,11.2 LCO2和乙炔的混合气体的物质的量n=11.2 L ÷22.4 L/mol=0.5 mol,而1 mol CO2和乙炔中均含2 molπ键,故0.5 mol混合气体中含1 mol π键,C正确;
D. CO2气体与Na2O2反应,产生Na2CO3和O2,增重的质量等于CO的质量,且每有2 mol CO2气体参与反应,增重2 mol CO的质量,转移2mol电子,故当增重28g时,增重的是CO的物质的量n(CO)=1 mol,转移了1 mol电子,D正确;
故合理选项是A。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案【题目】三氯胺(NCl3)是一种饮用水二级消毒剂,可由以下反应制备:
Ⅰ.![]()
![]()
回答下列问题:
(1)已知:Ⅱ.![]()
![]()
Ⅲ.![]()
![]()
则![]() =________(用含
=________(用含![]() 和
和![]() 的代数式表示)。
的代数式表示)。
(2)向容积均为2L的甲乙两个恒温密闭容器中分别加入4mol NH3和4mol Cl2,发生反应Ⅰ,测得两容器中n(Cl2)随反应时间的变化情况如下表所示:
时间/min | 0 | 40 | 80 | 120 | 160 |
容器甲(T1) | 4.0 | 3.0 | 2.2 | 1.6 | 1.6 |
容器乙(T2) | 4.0 | 2.9 | 2.0 | 2.0 | 2.0 |
①0~80min内,容器甲中v(NH3)=________________。
②反应Ⅰ的![]() ________0(填“>”或“<”),其原因为________________________。
________0(填“>”或“<”),其原因为________________________。
③关于容器乙,下列说法正确的是________(填选项字母)。
A.容器内![]() ,说明反应达到平衡状态
,说明反应达到平衡状态
B.反应进行到70min时,v正一定大于v逆
C.容器内气体平均相对分子质量在增大,说明平衡在正向移动
D.达平衡后,加入一定量NCl3(l),平衡逆向移动
E.达平衡后,按原投料比再充入一定量反应物,平衡后NH3的转化率增大
④温度为T1时HCl(g)的平衡体积分数=________,该温度下,若改为初始体积为2L的恒压容器,平衡时容器中n(Cl2)________(填“>”、“=”或“<”)1.6mol。
⑤温度为T2时,该反应的平衡常数K=________。