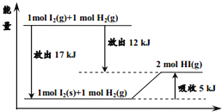
题目内容
【题目】废铅蓄电池的回收中产生大量的铅膏,回收利用铅膏能有效减少铅污染,充分利用铅资源。
(1)铅膏制备PbO。铅膏经过预处理后(主要成分为PbSO4)加入Na2CO3溶液,使之转化为PbCO3,然后充分灼烧得到PbO。
①PbCO3分解产生aPbCO3bPbO中间产物。PbCO3和PbSO4加热升温过程中固体的质量变化见图1。PbCO3在300 ℃时分解的产物为_____________。
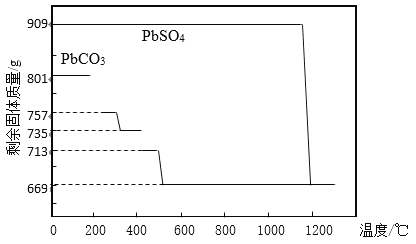
②工业上用PbCO3热分解制备的PbO而不直接热分解PbSO4制备的PbO的原因是_____________。
(2)沉淀除铅。铅膏经过转化后得到含铅的Na2SO4废液,需要进一步除去废水中的铅。
①常温下,该废液中![]() 浓度为0.01 mol·L1,则该废液中Pb2+浓度最大为_____________。[Ksp(PbSO4)=1.8×108]
浓度为0.01 mol·L1,则该废液中Pb2+浓度最大为_____________。[Ksp(PbSO4)=1.8×108]
②随温度升高和![]() 浓度增大废液中Pb2+浓度显著增大,所以工业通常采用向废液中加入Na2CO3、NaHCO3或NaOH等碱性沉淀剂产生Pb(OH)2沉淀除铅。废液随着pH的变化生成Pb(OH)2的质量如图2。向含铅废液中投放NaHCO3发生的离子方程式为_____________。在实际生产中采用NaHCO3或Na2CO3沉铅,不采用NaOH的原因是_____________。
浓度增大废液中Pb2+浓度显著增大,所以工业通常采用向废液中加入Na2CO3、NaHCO3或NaOH等碱性沉淀剂产生Pb(OH)2沉淀除铅。废液随着pH的变化生成Pb(OH)2的质量如图2。向含铅废液中投放NaHCO3发生的离子方程式为_____________。在实际生产中采用NaHCO3或Na2CO3沉铅,不采用NaOH的原因是_____________。

(3)电化学除铅。利用脉冲电源(间歇性通入电流)电解法转化废液中的Pb2+实现铅资源化利用,可以提高除铅效率(除铅效率与Pb2+浓度有关),其原理示意图3。
①写出阳极的电极反应式:__________。
②采用脉冲电解比普通电源电解的优点是__________。
【答案】PbCO3PbO 因为PbSO4分解温度高,消耗能量多,产生硫的氧化物,污染大 1.8×10-6mol/L Pb2++2HCO3-=Pb(OH)2↓+2CO2↑ NaOH的碱性强,容易与Pb(OH)2反应而使其溶解,而使用NaHCO3或Na2CO3溶液,碱性弱,容易控制pH,从而最大限度的使铅沉淀。 4OH--4e-=O2↑+2H2O 可以让阴、阳离子充分的移动到阳极和阴极附近,电极区相关离子浓度更大,有利于电解。
【解析】
由图1,根据固体质量的变化值,可求出分解产物;由图1,根据PbCO3和PbSO4分解完全,温度不同,产物不同来解答;根据Ksp可计算Pb2+浓度;根据图2,可判断采用NaHCO3或Na2CO3沉铅,不采用NaOH的理由;根据图3可判断电解池的阴阳极,据此解答。
(1)①如图所示,m(PbCO3)=801g,300℃时剩余固体质量m=735g,△m=801g-735g=66g,根据(a+b)PbCO3![]() aPbCO3bPbO+bCO2,得出
aPbCO3bPbO+bCO2,得出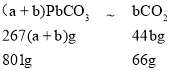 ,267(a+b)×66=801×44b,解之,a=b,化学方程式为2PbCO3
,267(a+b)×66=801×44b,解之,a=b,化学方程式为2PbCO3![]() PbCO3PbO+CO2,产物为PbCO3PbO;答案为PbCO3PbO。
PbCO3PbO+CO2,产物为PbCO3PbO;答案为PbCO3PbO。
②由图1可知,PbCO3分解完全只需500℃,产物为PbO和CO2,PbSO4分解完全需要1200℃,且产生硫的氧化物,因而PbSO4分解温度高,消耗能量多,产生硫的氧化物,污染大;答案为因为PbSO4分解温度高,消耗能量多,产生硫的氧化物,污染大。
(2)①因为Ksp(PbSO4)=1.8×10-8,Ksp(PbSO4)=c(Pb2+)×c(SO42-),已知c(SO42-)=0.01mol/L,则c(Pb2+)=![]() =
= ![]() =1.8×10-6mol/L;答案为1.8×10-6mol/L。
=1.8×10-6mol/L;答案为1.8×10-6mol/L。
②向含铅废液中投放NaHCO3,则HCO3-与Pb2+反应,生成Pb(OH)2沉淀,根据原子守恒,可判断还有CO2产生,则离子方程式为Pb2++2HCO3-=Pb(OH)2↓+2CO2↑,由图2可知,pH=10时,Pb(OH)2沉淀量最大,如果使用NaOH,它的碱性强,容易超过pH=10,而使Pb(OH)2溶解,使用NaHCO3或Na2CO3溶液,碱性弱,容易控制pH,从而最大限度地使铅沉淀;答案为Pb2++2HCO3-=Pb(OH)2↓+2CO2↑,NaOH的碱性强,容易与Pb(OH)2反应而使其溶解,而使用NaHCO3或Na2CO3溶液,碱性弱,容易控制pH,从而最大限度地使铅沉淀。
(3)①根据图3,是一个电解池,阳极应该是石墨,如果是铜,会牺牲阳极,阳极区电解液是NaNO3,根据OH-的放电能力大于NO3-,所以阳极的电极反应为4OH--4e-=O2↑+2H2O,答案为4OH--4e-=O2↑+2H2O。
②因为在电解过程中,离子浓度会迅速降低,采用脉冲电解,在断电间隙时间内,可以让阴、阳离子充分的移动到阳极和阴极附近,离子浓度又会得到迅速恢复和补充,电极区相关离子浓度更大,有利于电解;答案为可以让阴、阳离子充分的移动到阳极和阴极附近,电极区相关离子浓度更大,有利于电解。

 阅读快车系列答案
阅读快车系列答案