��Ŀ����
����Ŀ������������ѧ��ͨ�����Ӽ�����������һ�ܵ�ʵ�飬�����6���dz�������![]() ԭ�ӣ����ţ���ѧ����ʹ�����ƵIJ��������۲����6��ԭ������4��������˥�䣬��һʵ��֤ʵ������Ԥ�Ե�˫����˥�䷽ʽ������һ��ԭ��ͬʱ�ų��������ӵ�˥�䷽ʽ���ش��������⣺
ԭ�ӣ����ţ���ѧ����ʹ�����ƵIJ��������۲����6��ԭ������4��������˥�䣬��һʵ��֤ʵ������Ԥ�Ե�˫����˥�䷽ʽ������һ��ԭ��ͬʱ�ų��������ӵ�˥�䷽ʽ���ش��������⣺
(1) ![]() ԭ�ӵĺ���������Ϊ________����ԭ�ӵĺ��������Ϊ________��
ԭ�ӵĺ���������Ϊ________����ԭ�ӵĺ��������Ϊ________��
(2)���¹���![]() ��������ȷ����________(����ĸ���)��
��������ȷ����________(����ĸ���)��
A�� ![]() ��
��![]() �����ֺ���
�����ֺ���
B����ѧ�һ����һ����Ԫ��
C�� ![]() ��˥�䲻�ǻ�ѧ�仯
��˥�䲻�ǻ�ѧ�仯
D��������ԭ��˥��ų��������Ӻ���![]()
(3)ijͬѧ��Ϊ![]() ��һ��������Ҳ����������Ӧ�������ж�������___________________________��
��һ��������Ҳ����������Ӧ�������ж�������___________________________��
���𰸡� 19 26 AC ![]() ��
��![]() �ĺ�������Ų���ͬ����ѧ���ʼ�����ȫ��ͬ
�ĺ�������Ų���ͬ����ѧ���ʼ�����ȫ��ͬ
��������(1) ![]() ��������=��������������=45��26=19��������=������=26��(2)A��
��������=��������������=45��26=19��������=������=26��(2)A��![]() ��
��![]() ����������ͬ����ͬһԪ��FeԪ�أ�����������ͬ�������ֲ�ͬ�ĺ��أ�A��ȷ��B������A�з�����֪FeԪ�ز���һ����Ԫ�أ�B����C��
����������ͬ����ͬһԪ��FeԪ�أ�����������ͬ�������ֲ�ͬ�ĺ��أ�A��ȷ��B������A�з�����֪FeԪ�ز���һ����Ԫ�أ�B����C��![]() ˥��ų��������Ӻ��Ϊ������Ϊ24����ԭ�ӣ�ԭ�Ӻ˷����˱仯�����ǻ�ѧ�仯����Ϊ��ѧ�ķ�������ԭ�ӡ�����ˮƽ���о����ʣ�C��ȷ��D������C�з�����֪D����ѡAC��(3)
˥��ų��������Ӻ��Ϊ������Ϊ24����ԭ�ӣ�ԭ�Ӻ˷����˱仯�����ǻ�ѧ�仯����Ϊ��ѧ�ķ�������ԭ�ӡ�����ˮƽ���о����ʣ�C��ȷ��D������C�з�����֪D����ѡAC��(3) ![]() ��
��![]() �ĺ�������Ų���ͬ����ѧ���ʼ�����ȫ��ͬ�������һ��������Ҳ����������Ӧ��
�ĺ�������Ų���ͬ����ѧ���ʼ�����ȫ��ͬ�������һ��������Ҳ����������Ӧ��

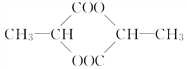
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ������ˮ�к�����ᵼ�����ж���ˮ�����ܽ������Ҫ��As�����������κ�As��������������ʽ���ڣ�
��1��������Ϊͬһ����Ԫ�أ���ԭ�ӽṹʾ��ͼΪ ��
��2������Ԫ�������ɣ�����˵����ȷ���� ��
a�����ԣ�H2SO4��H3PO4��H3AsO4
b��ԭ�Ӱ뾶��S��P��As
c���ǽ����ԣ�S��P��As
��3�����ڵ���ˮ�������Դ�ж��ּ��裬����һ����Ϊ�Ǹ�����Ļ�����FeS2��������ΪFe��OH��3 �� ͬʱ����SO42�� �� �������������������ˮ��FeS2��O2���������ӷ���ʽΪ ��
��4��ȥ��ˮ���е��飬���Ƚ�As����ת��ΪAs��������ѡ��NaClO��ʵ�ָ�ת�����о�NaClOͶ������As���������ʵ�Ӱ��õ����½����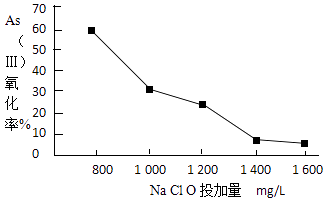
��֪��Ͷ��ǰˮ��pH=5.81��0.1mol/LNaClO��ҺpH=10.5����Һ�����������õ������Ǵ����ᣮ�����˽����ԭ���� ��
��5��ǿ�����ӽ�����������������������̬���ڵ�As�������ﵽȥ��As��Ŀ�ģ�
��֪��һ�������£�As�������Ĵ�����ʽ�����ʾ��
pH | ��2 | 2��7 | 7��11 | 11��14 |
������ʽ | H3AsO4 | H2AsO3�� | HAsO42�� | HAsO42����AsO43�� |
pH=6ʱ��NaClO���������ᣨH3AsO3�������ӷ���ʽ�� ��