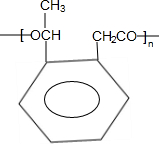
题目内容
8.对于反应:K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O,若有0.1molK2Cr2O7参加反应,下列说法正确的是( )| A. | 被氧化的HCl为1.4mol | B. | 转移电子数1.806×1023 | ||
| C. | 氧化产物为0.4mol | D. | 还原剂占参加反应HCl的$\frac{3}{7}$ |
分析 K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O,该反应中,氯元素失电子化合价由-1价升高到0价,Cr元素从+6价降低到+3价,1molK2Cr2O7参加反应时,消耗14molHCl其中只有6mol被氧化,据此分析.
解答 解:A.1molK2Cr2O7参加反应时,消耗14molHCl其中只有6mol被氧化,则0.1molK2Cr2O7参加反应时,被氧化的HCl为0.6mol,故A错误;
B.0.1molK2Cr2O7参加反应时,被氧化的HCl为0.6mol,转移电子数3.612×1023,故B错误;
C.0.1molK2Cr2O7参加反应时,被氧化的HCl为0.6mol,生成0.3molCl2,故C错误;
D.1molK2Cr2O7参加反应时,消耗14molHCl其中只有6mol被氧化,则还原剂占参加反应HCl的$\frac{3}{7}$,故D正确.
故选D.
点评 本题考查了氧化还原反应,注意根据元素化合价变化分析解答,侧重于考查学生的分析能力,题目难度不大.

练习册系列答案
相关题目
18.下列仪器中,实验时仪器的下端必须插入液面下的是( )
| A. | 分馏石油时的温度计 | B. | 制备氢气的简易装置中的长颈漏斗 | ||
| C. | 制备氯气装置中的分液漏斗 | D. | 制备乙酸乙酯时冷凝蒸气的导管 |
19.下列说法正确的是 ( )
| A. | 饮用水就是纯水,是纯净物 | |
| B. | 有机食品,就是有机合成的食品 | |
| C. | 将化工厂的烟囱建高,不能缓解大气污染 | |
| D. | 燃煤时,鼓入过量的空气可以减少酸雨的产生 |
16.下列物质中不能使酸性高锰酸钾溶液褪色的是( )
| A. | CH≡CH | B. | CH2=CH2 | C. | 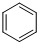 | D. | 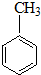 |
13.下列反应的离子方程式正确的是( )
| A. | 用氨水吸收少量的二氧化硫:NH3•H2O+SO2═NH4++HSO3- | |
| B. | 硫酸亚铁溶液中加入过氧化氢溶液:Fe2++2H2O2+4H+═Fe3++4H2O | |
| C. | 次氯酸钙溶液中通入过量的二氧化碳:ClO-+H2O+CO2═HCO3-+HClO | |
| D. | 碳酸钠溶液中慢慢滴入少量稀盐酸:CO32-+2H+═CO2↑+H2O |
17.下列除杂(括号内的为杂质)试剂、方法和相关反应不正确的是( )
| A. | FeCl2(FeCl3)--加入足量铁粉,然后过滤,Fe+2FeCl3═3FeCl2 | |
| B. | NaCl(NaI)--加入适量氯水,用CCl4萃取分液,Cl2+2NaI═2NaCl+I2 | |
| C. | SiO2(Al2O3)--加入足量NaOH溶液,然后过滤,Al2O3+2NaOH═2NaAlO2+H2O | |
| D. | CaCl2(NH4Cl) 固体混合物--直接加热NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+HCl↑ |
18.2gAO32-的核外电子数比质子数多3.01×1022个,则A的相对原子质量为( )
| A. | 12 | B. | 32 | C. | 60 | D. | 80 |
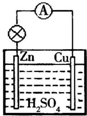 原电池是一种将化学能转化为电能的装置;在Cu-Zn原电池(H2SO4做电解质溶液)中,Zn极发生氧化反应,是负极,电极反应式为Zn-2e-=Zn2+;Cu极发生还原反应,是正极,电极反应式为2H++2e-=2H2↑.
原电池是一种将化学能转化为电能的装置;在Cu-Zn原电池(H2SO4做电解质溶液)中,Zn极发生氧化反应,是负极,电极反应式为Zn-2e-=Zn2+;Cu极发生还原反应,是正极,电极反应式为2H++2e-=2H2↑.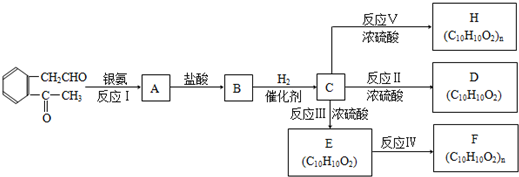
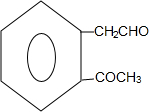 +2Ag(NH3)2OH→
+2Ag(NH3)2OH→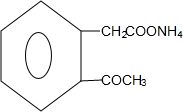 +2Ag↓+3NH3+H2O;
+2Ag↓+3NH3+H2O; $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$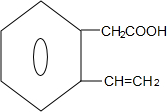 +H2O
+H2O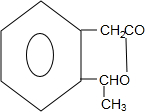 F
F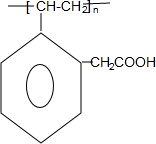 H
H