题目内容
(1)现有如下两个反应:
(A)NaOH + HCl =" NaCl" + H2O (B)2FeCl3 + Cu = 2FeCl2 + CuCl2
①根据两反应本质和特点,判断(A)和(B)分别能否设计成原电池 ;
②如果不能,说明其原因 。
(2)选择适宜的材料和试剂设计一个原电池,电池的总反应为:Zn + CuSO4 = ZnSO4 + Cu,分别写出电池两极的电极反应式,正极 ,负极 。
(10分)(1)①(A)不能,(B)可以 (4分)
②(A)的反应是非氧化还原反应,没有电子转移(其他合理答案也给分)(2分)
(2)负极:Zn–2e-= Zn2+ (2分) 正极:Cu2+ + 2e-=Cu (2分)
解析试题分析:(1)只有氧化还原反应才能设计成原电池,(A)的反应是非氧化还原反应,没有电子转移,不能设计成原电池。(B)反应是氧化还原反应,可以设计成原电池。
(2)原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。关键方程式可知,在反应中锌失去电子,是还原剂,做负极,电极反应式是Zn–2e-= Zn2+;正极得到电子,溶液中的铜离子子正极得到电子,电极反应式是Cu2+ + 2e-=Cu。
考点:考查原电池的有关判断、电极反应式的书写等
点评:该题是高考中的常见考点,属于基础性试题的考查,难度不大。该题的关键是明确原电池的工作原理、构成条件以及电极反应式的书写、电极名称的判断,然后结合题意灵活运用即可,有利于培养学生的逻辑推理能力和规范答题能力。

 名校课堂系列答案
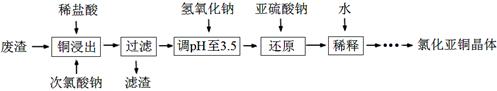
名校课堂系列答案(8分)已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应)。某化学兴趣小组在实验室条件下用以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。步骤一:电解精制:
请回答以下问题:电解时,阴极上的电极反应式为 ;
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:
(1)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式: 。
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
| 序号 | 反应 | 平衡常数 |
| 1 | Au + 6HNO3(浓)= Au(NO3)3 + 3NO2↑+ 3H2O | << 1 |
| 2 | Au3+ + 4Cl— = AuCl4— | >>1 |
从中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比1∶3的混合物),请你简要解释金能够溶于王水的原因:
(2)滤液含量的测定: 以下是该小组探究滤液的一个实验流程:

则100ml滤液中Fe2+的浓度为 mol·L-1
近年来,为提高能源利用率,西方提出共生理念——为提高经济效益,人类生产活动尽可能多功能化.共生工程将会大大促进化学工业的发展.
(1)由于共生工程的应用,利用发电厂产生的SO2制成自发电池,其电池反应方程式为:2SO2+O2+2H2O=2H2SO4,该电池电动势为1.06V.实际过程中,将SO2通入电池的 极(填“正”或“负”),负极反应式为 .用这种方法处理SO2废气的优点是 .
(2)以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质.合成路线如下:
①生产中,向反应Ⅱ中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是 .
②下列有关说法正确的是 .
| A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙 |
B.反应Ⅲ中发生反应的化学方程式为CaSO4+4C CaS+4CO↑ CaS+4CO↑ |
| C.反应Ⅳ需控制在60~70℃,目的之一是减少碳酸氢铵的分解 |
| D.反应Ⅴ中的副产物氯化铵可用作氮肥 |
④(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统.写出二氧化氮与亚硫酸铵反应的化学方程式 .
某含碳?氢?氧的有机物A能发生如图所示的变化:已知A?C?D?E均能在一定条件下与新制的氢氧化铜悬浊液反应生成红色沉淀,则A的同分异构体是
| A.乙酸 | B.甲酸乙酯 | C.甲酸甲酯 | D.乙酸甲酯 |
 O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1 [Cu(NH3)3]Ac·CO △H<0
[Cu(NH3)3]Ac·CO △H<0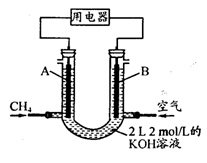
 CH3OH(g)。在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如右图所示。
CH3OH(g)。在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如右图所示。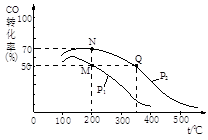
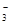 还原为N2,一段时间后,溶液的碱性明显增强。则该反应离子方程式为 。
还原为N2,一段时间后,溶液的碱性明显增强。则该反应离子方程式为 。
 Cu2++
Cu2++ CuCl+Cl- K=2.32
CuCl+Cl- K=2.32