��Ŀ����
��15�֣��Ȼ���ͭ��CuCl����һ�ְ�ɫ���壬����ˮ�������ھƾ����о������ʵ�Ӧ�������������·��������������еĻ����´�ʩ��������Ҫ���塣
��1��þ���Ȼ���ͭ��ˮ��أ������������ϡ��õ�ر���ˮ����ʱ����������������ǿ��ͬʱ�������ݣ��������ϱ���ԭ�������� �� ���ѧʽ����
��2����ҵ����ͭ���������ȴ������۷�Ӧ�ϳɼ��ȹ���Ĺ����в���������������Ҫ�ɷ�Ϊ��ۡ�ͭ��̼�ȣ���ij����С���Ը÷���Ϊԭ����CuCl������ʾ��ͼ���£�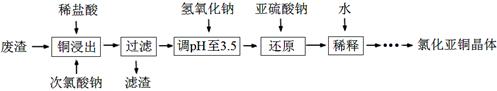
�ش��������⣺
���ȴ�������4�֣�����������Ҫ��ҵ�ܼ����� ��д����ѧʽ����
�ڡ���ԭ���Σ�SO32����Cu2����ԭ��[CuCl2]��������������ӷ���ʽ�� Cu2��+
Cu2��+ Cl��+
Cl��+ SO32��+
SO32��+ ��
�� [CuCl2]��+
[CuCl2]��+ +
+
����ϡ�����д�����������ƽ�⣺
�� [CuCl2]�� CuCl��Cl�� K��2.32
CuCl��Cl�� K��2.32
�� CuCl(s) Cu+(aq)��Cl�� Ksp��1.2��10��6
Cu+(aq)��Cl�� Ksp��1.2��10��6
��[CuCl2]�����ת��ʱ��c([CuCl2]��)��1.0��10��5 mol��L��1������Һ��c(Cu��)�� ��
�ܻ��CuCl�����辭���ˡ�ϴ�ӡ����ϴ��ʱ��������ˮ�Ҵ���������ˮ��ϴ�Ӽ����ŵ��� ��дһ�㣩��
��3����ҵ����CuCl�����в���Ũ��Ϊ2��3 g��L��1�ĺ�ͭ��ˮ�����˼��������нϴ��Σ����������л������á�����ȡ��������ˮ�е�ͭ���������£�
��ʵ������ɲ��袡ʱ�������ڷ�Һ©���м���������ķ�ˮ���л���ȡ�������� ����������̨����Ȧ�Ͼ���Ƭ�̣��ֲ㡣�������²�Һ��ʱ��Ӧ�� ��Ȼ������ų��²�Һ�壬�ϲ�Һ����Ͽڵ�����
��д�����袢�����ӷ���ʽ�� ��
��1��CuCl��H2O����H��������1�֣���2�֣� ��2����CHCl3��CCl4����дһ���͵÷֣�1�֣�
��2Cu2����4Cl����1SO32����1 H2O ��2[CuCl2]����1 SO42�� ��2 H����3�֣�
��5.17��10-2mol��L-1 ��2�֣� �ܱ���CuCl����ˮ����ʧ�������������𰸣���2�֣�
��3���ٷ�����1�֣� ���Ͽڲ���������ʹ���ϵİ��۶�©�����ϵ�С�ף���1�֣�
��R2Cu��2H����Cu2����2RH��3�֣�
���������������1��þ�ǻ��õĽ����������þ���Ȼ���ͭ��ˮ�����þ�Ǹ�����ʧȥ���ӣ������õ����ӣ�������ԭ��Ӧ���õ�ر���ˮ����ʱ����������������ǿ��ͬʱ�������ݣ�������Ӧ������������˵�������ϵõ����ӵ�������CuCl��H2O����H������
��2�����ȴ�������4�֣�����������Ҫ��ҵ�ܼ�����CHCl3��CCl4��
�ڸ��ݷ���ʽ��֪���ڷ�Ӧ��ͭԪ�صĻ��ϼ۴ӣ�2�۽��͵�+1�ۣ��õ�1�����ӡ���Ԫ�صĻ��ϼ۴�+4�����ߵ�+6�ۣ�ʧȥ2�����ӣ����Ը��ݵ��ӵ�ʧ�غ��֪�������뻹ԭ�������ʵ���֮����2:1.����ԭ���غ�͵���غ��֪����Ӧǰ����ˮ�μӣ���Ӧ�������������ɣ������ƽ������ӷ���ʽΪ2Cu2����4Cl����SO32����H2O ��2[CuCl2]����SO42�� ��2H����
�۸��ݷ���ʽ��֪K�� ��Ksp��c(Cu��)��c(Cl��)����c(Cu��)��
��Ksp��c(Cu��)��c(Cl��)����c(Cu��)��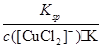 ����ˣ�c([CuCl2]��)��1.0��10��5 mol��L��1������Һ��c(Cu��)��5.17��10-2mol��L-1��
����ˣ�c([CuCl2]��)��1.0��10��5 mol��L��1������Һ��c(Cu��)��5.17��10-2mol��L-1��
��CuCl���л��ܼ��е��ܽ��С�ܣ�����ˮ�Ҵ���������ˮ���Ա���CuCl����ˮ����ʧ��
��3�������������й���ʱ��������ҺʱӦ�ô��Ͽڲ���������ʹ���ϵİ��۶�©�����ϵ�С�ף���
��ͭ�����������ӽ�������ˮ�㣬��˷�Ӧ�����ӷ���ʽΪR2Cu��2H����Cu2����2RH��
���㣺����ԭ���Ӧ�á�������ԭ��Ӧ��ƽ���ܽ�ƽ�⡢��ȡ��Һ�Լ����ӷ���ʽ����д

ij����С��ֱ�����ͼ��ʾװ�ö�ԭ��غ͵��ԭ������ʵ��̽����
��ش�
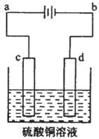
I����ͼ1��ʾװ�ý��е�һ��ʵ�顣
��1���ڱ�֤�缫��Ӧ���������£��������Cu���缫���� ������ĸ��ţ���
| A���� | B��ʯī | C���� | D���� |
��3��ʵ������У�SO42- ����������ҡ������������������ƶ�����ֽ���ܹ۲쵽�������� ��
II����ͼ2��ʾװ�ý��еڶ���ʵ�顣ʵ������У������������������Y������Һ����Ϻ�ɫ��ֹͣʵ�飬���缫���Ա�ϸ�����Һ��Ȼ���塣�������Ϸ��֣����������FeO42-������Һ�г��Ϻ�ɫ��
��4���������У�X������Һ��pH ������� ������С�����䡱����
��5���������У�Y�������ĵ缫��ӦΪFe - 6e- + 8OH-��FeO42- + 4H2O��4OH- - 4e-�� 2H2O + O2�� �� ����X���ռ���672 mL���壬��Y���ռ���168 mL���壨��������Ϊ��״��ʱ�������������Y�缫�����缫���������� g��
��6���ڼ���п����У��ø��������Ϊ�������ϣ���ط�ӦΪ��2K2FeO4 + 3Zn ��Fe2O3 +ZnO +2K2ZnO2
�õ�����������ķ�Ӧ�ĵ缫��ӦʽΪ ��
��7��Ag2O2����п���Ե�ص������������ʣ���������ҺΪ KOH ��Һ����طŵ�ʱ������Ag2O2ת��ΪAg��������Znת��ΪK2Zn(OH)4��д���õ�ط�Ӧ����ʽ��____________________________��
����Cu2O���ھ��������Ĵ����ܶ��ܵ���ע���±�Ϊ��ȡCu2O�����ַ�����
| ������ | ��̿���ڸ��������»�ԭCuO |
| ������ | ��ⷨ����ӦΪ2Cu + H2O  Cu2O + H2���� Cu2O + H2���� |
| ������ | ���£�N2H4����ԭ����Cu(OH)2 |
��1����ҵ�ϳ��÷�����ͷ�������ȡCu2O�������÷�������ԭ���Ƿ�Ӧ���������ƣ������²��������� ��ʹCu2O���ʽ��͡�
��2����֪��2Cu(s)��1/2O2(g)=Cu2O(s) ��H =-akJ��mol-1
C(s)��1/2O2(g)=CO(g) ��H =-bkJ��mol-1
Cu(s)��1/2O2(g)=CuO(s) ��H =-ckJ��mol-1
�������ķ�Ӧ��2CuO(s)��C(s)= Cu2O(s)��CO(g)����H = kJ��mol-1��
��3��������������ӽ���Ĥ���Ƶ��Һ��OH-��Ũ�ȶ��Ʊ�����Cu2O��װ����ͼ��ʾ���õ�ص���������Cu2O��ӦʽΪ ��

��4��������Ϊ������������Һ̬�£�N2H4����ԭ����Cu(OH)2���Ʊ�����Cu2O��ͬʱ�ų�N2�����Ʒ��Ļ�ѧ����ʽΪ ��
��5������ͬ���ܱ������У����������ַ����Ƶõ�Cu2O�ֱ���д��ֽ�ˮ��ʵ�飺

ˮ������Ũ�ȣ�mol/L����ʱ��t(min)�仯���±���ʾ��
| ��� | �¶� | 0 | 10 | 20 | 30 | 40 | 50 |
| �� | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| �� | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| �� | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
A��ʵ����¶�T2С��T1
B��ʵ���ǰ20 min��ƽ����Ӧ����v(O2)=7��10-5 mol��L-1 min-1
C��ʵ��ڱ�ʵ������õĴ�����Ч�ʸ�
����˵���������
| A����ˮ��Һ���������еġ�CH3���Ե����H�� |
| B����������ǡ��˴Ź����ǡ������Ƕ��������л�������ṹ�ķ��� |
| C���ý����ƿ������Ҵ������� |
| D���������ᴿ�����ʲ��������������� |



 Zn���,���ò�����Ƴ�һ���������Ǻ�������ɵ�СԲ��,���ڿ�������һ�����Ag2O������ʯī��ɵ��������Բ���,������һ�����Zn
Zn���,���ò�����Ƴ�һ���������Ǻ�������ɵ�СԲ��,���ڿ�������һ�����Ag2O������ʯī��ɵ��������Բ���,������һ�����Zn
 Cr2O72-����ɫ��+H2O
Cr2O72-����ɫ��+H2O