题目内容
【题目】写出下列反应的化学方程式:
(1)钠在氯气中燃烧___;
(2)铝与硫蒸气反应___;
(3)铁在氯气中燃烧___;
(4)铁与硫蒸气反应___;
(5)铜在氯气中燃烧___;
(6)铜与硫蒸气反应___。
【答案】2Na+Cl2![]() 2NaCl 2Al+3S
2NaCl 2Al+3S![]() Al2S3 2Fe+3Cl2
Al2S3 2Fe+3Cl2![]() 2FeCl3 Fe+S
2FeCl3 Fe+S![]() FeS Cu+Cl2
FeS Cu+Cl2![]() CuCl2 2Cu+S
CuCl2 2Cu+S![]() Cu2S
Cu2S
【解析】
根据氯气和硫的化学性质进行分析;
(1)钠与氯气反应生成NaCl,即反应方程式为2Na+Cl2![]() 2NaCl;
2NaCl;
答案为:2Na+Cl2![]() 2NaCl;
2NaCl;
(2)铝与硫反应生成硫化铝,其反应方程式为2Al+3S![]() Al2S3;
Al2S3;
答案为:2Al+3S![]() Al2S3;
Al2S3;
(3)铁在氯气中燃烧生成FeCl3,其反应方程式为2Fe+3Cl2![]() 2FeCl3;
2FeCl3;
答案为:2Fe+3Cl2![]() 2FeCl3;
2FeCl3;
(4)硫的氧化性较弱,只能将Fe氧化成+2价,即反应方程式为Fe+S![]() FeS;
FeS;
答案为:Fe+S![]() FeS;
FeS;
(5)Cu在氯气中燃烧,其反应方程式为Cu+Cl2![]() CuCl2;
CuCl2;
答案为Cu+Cl2![]() CuCl2;
CuCl2;
(6)Cu和S反应2Cu+S![]() Cu2S;
Cu2S;
答案为:2Cu+S![]() Cu2S。
Cu2S。

 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
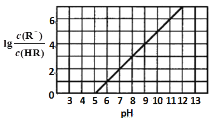
小题狂做系列答案【题目】草酸![]() 是一种重要的化工原料。某学习小组为探究草酸的性质,查阅了有关资料,草酸的部分性质如下表:
是一种重要的化工原料。某学习小组为探究草酸的性质,查阅了有关资料,草酸的部分性质如下表:
物质 | 性质 |
|
|
实验Ⅰ:根据图提供的仪器和试剂,设计实验证明草酸的受热分解产物中含有![]() 和
和![]() 部分夹持仪器和加热装置省略
部分夹持仪器和加热装置省略![]()
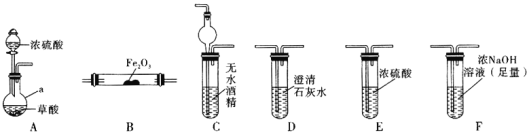
(1)仪器a的名称是_____________。
(2)各装置的正确连接顺序为![]() 装置可重复使用
装置可重复使用![]() ________
________![]() ________
________![]() ________
________![]() ________
________![]() 尾气处理。________________
尾气处理。________________
(3)用图中装置C的作用是____________________________。
(4)连接好装置进行的实验时,要先加热________![]() 填“A”“B”“C”“D”“E”或“F”
填“A”“B”“C”“D”“E”或“F”![]() 装置,能证明分解产物中有CO的实验依据是___________________。
装置,能证明分解产物中有CO的实验依据是___________________。
(5)某同学查阅资料发现,用氯化钯![]() 磷钼酸溶液可检验一氧化碳。一氧化碳与氯化钯溶液反应,生成了黑色的金属钯
磷钼酸溶液可检验一氧化碳。一氧化碳与氯化钯溶液反应,生成了黑色的金属钯![]() 固体,反应的化学方程式是___________________________。
固体,反应的化学方程式是___________________________。
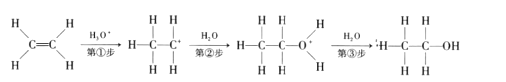
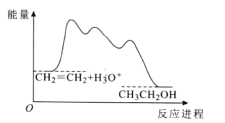
实验 Ⅱ:草酸与甲醇在浓硫酸存在下酯化生成草酸二甲酯。反应为![]()
![]()
![]() 。在装有搅拌器、分水器的反应瓶中,加入草酸
。在装有搅拌器、分水器的反应瓶中,加入草酸![]() ,无水甲醇
,无水甲醇![]() ,苯
,苯![]() ,浓硫酸
,浓硫酸![]() ,搅拌下加热回流共沸脱水20小时,后转移到烧杯中冷却,按如图所示流程提纯。
,搅拌下加热回流共沸脱水20小时,后转移到烧杯中冷却,按如图所示流程提纯。
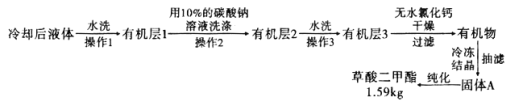
(6)![]() 提纯过程中用
提纯过程中用![]() 的碳酸钠溶液洗涤的作用是__________________________。
的碳酸钠溶液洗涤的作用是__________________________。
![]() 流程中纯化的方法为________________。
流程中纯化的方法为________________。
![]() 产率为____________
产率为____________![]() 精确到
精确到![]() 。
。
【题目】下列实验操作与预期实验目的或所得实验结论一致的是( )
选项 | 实验操作 | 实验目的或结论 |
A | 向废FeCl3蚀刻液X中加入少量的铁粉,振荡,未出现红色固体 | X中一定不含Cu2+ |
B | 向AgCl悬浊液中滴入少量KI溶液,有黄色沉淀生成 | 说明Ksp(AgCl)>Ksp(AgI) |
C | 制备乙酸乙酯的实验,将蒸出的乙酸乙酯蒸汽导在饱和的NaOH溶液液面以上 | 防止倒吸,便于分层 |
D | 向某溶液中滴加氯水,再滴加KSCN溶液,溶液变成红色 | 该溶液中一定含有Fe2+ |
A.AB.BC.CD.D