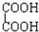题目内容
有下列事实:①由乙烯制乙醇 ②甲烷在空气中燃烧 ③由乙炔制氯乙烯 ④甲苯与氯气反应 ⑤苯和浓硝酸反应 ⑥用丙烯制聚丙烯.其中
(1)属于取代反应的是(填序号,下同) ,
(2)属于氧化反应的是 ,
(3)属于加成反应的是 ,
(4)属于加聚反应的是 .
(5)写出③⑤发生的化学反应方程式:③ ⑤ .
(1)属于取代反应的是(填序号,下同)
(2)属于氧化反应的是
(3)属于加成反应的是
(4)属于加聚反应的是
(5)写出③⑤发生的化学反应方程式:③
考点:有机物的结构和性质,有机化学反应的综合应用
专题:有机反应
分析:①由乙烯制乙醇,为乙烯和水的加成反应;
②甲烷在空气中燃烧,反应生成二氧化碳和水,为氧化反应;
③由乙炔制氯乙烯,为乙炔和HCl的加成反应;
④甲苯与氯气反应,甲苯中的H被取代,为取代反应;
⑤苯和浓硝酸反应,生成硝基苯,苯环上的H被硝基取代;
⑥用丙烯制聚丙烯,碳碳双键断裂生成高分子,为加聚反应,以此来解答.
②甲烷在空气中燃烧,反应生成二氧化碳和水,为氧化反应;
③由乙炔制氯乙烯,为乙炔和HCl的加成反应;
④甲苯与氯气反应,甲苯中的H被取代,为取代反应;
⑤苯和浓硝酸反应,生成硝基苯,苯环上的H被硝基取代;
⑥用丙烯制聚丙烯,碳碳双键断裂生成高分子,为加聚反应,以此来解答.
解答:
解:①由乙烯制乙醇,为乙烯和水的加成反应;
②甲烷在空气中燃烧,反应生成二氧化碳和水,为氧化反应;
③由乙炔制氯乙烯,为乙炔和HCl的加成反应;
④甲苯与氯气反应,甲苯中的H被取代,为取代反应;
⑤苯和浓硝酸反应,生成硝基苯,苯环上的H被硝基取代,属于取代反应;
⑥用丙烯制聚丙烯,碳碳双键断裂生成高分子,为加聚反应,
(1)由上述分析可知,属于取代反应的是④⑤,故答案为:④⑤;
(2)属于氧化反应的是②,故答案为:②,
(3)属于加成反应的是①③,故答案为:①③,
(4)属于加聚反应的是⑥,故答案为:⑥;
(5)③发生的化学反应方程式为CH≡CH+HCl
CH2=CHCl,⑤发生的化学反应方程式为 ,
,
故答案为:CH≡CH+HCl
CH2=CHCl; .
.
②甲烷在空气中燃烧,反应生成二氧化碳和水,为氧化反应;
③由乙炔制氯乙烯,为乙炔和HCl的加成反应;
④甲苯与氯气反应,甲苯中的H被取代,为取代反应;
⑤苯和浓硝酸反应,生成硝基苯,苯环上的H被硝基取代,属于取代反应;
⑥用丙烯制聚丙烯,碳碳双键断裂生成高分子,为加聚反应,
(1)由上述分析可知,属于取代反应的是④⑤,故答案为:④⑤;
(2)属于氧化反应的是②,故答案为:②,
(3)属于加成反应的是①③,故答案为:①③,
(4)属于加聚反应的是⑥,故答案为:⑥;
(5)③发生的化学反应方程式为CH≡CH+HCl
| 催化剂 |
 ,
,故答案为:CH≡CH+HCl
| 催化剂 |
 .
.
点评:本题考查有机物的结构与性质,为高频考点,把握常见有机物的性质及发生的反应为解答的关键,侧重有机物性质及反应类型的考查,题目难度不大.

练习册系列答案
相关题目
已知某有机物A的红外光谱和核磁共振氢谱如图所示,下列说法不正确的是( )
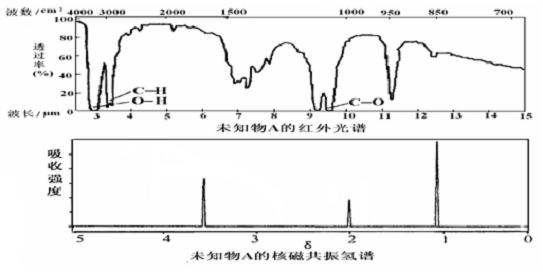

| A、由红光外谱可知,该有机物中至少有三种不同的化学键 |
| B、由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子 |
| C、仅由其核磁共振氢谱无法得知其分子中的氢原子总数 |
| D、若A的化学式为C3H6O,则其结构简式为CH3CH2CHO |
将一定量铁粉溶于1L稀硝酸中恰好完全反应,放出NO气体的体积为4.48L(标准状况下),则原溶液中硝酸的浓度为( )
| A、1.0mol?L-1 |
| B、0.8mol?L-1 |
| C、0.6mol?L-1 |
| D、0.4mol?L-1 |
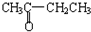
 与
与
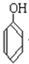 与
与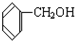
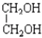 与
与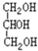
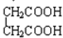 与
与