题目内容
对于反应2SO2+O2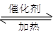 2SO3,下列判断正确的是
2SO3,下列判断正确的是
| A.2 mol SO2和足量的O2反应,一定生成2mol SO3 |
| B.平衡时SO2、O2、SO3的分子数之比为2∶1∶2 |
| C.平衡时SO2的消耗速率等于O2的生成速率的2倍 |
| D.平衡时SO2的浓度为O2浓度的2倍 |
C
解析试题分析:A、可逆反应中反应物不可能全部转化为生成物,2mol二氧化硫与氧气反应,生成的SO3的物质的量一定小于2mol,故A错误;B、平衡时SO2、O2、SO3三种物质的分子个数之比与化学计量数没有必然的联系,达到平衡状态,一定满足正逆反应速率相等,各组分浓度不变,故B错误;C、平衡时,O2的生成速率等于O2的消耗速率,故SO2的消耗速率为O2的生成速率的2倍,故C正确;D、平衡时SO2的浓度与O2的浓度关系与反应起始的投料量有关,题中数据无法判断达到平衡时二氧化硫和氧气的浓度关系,故D错误;故选C。
考点:考查可逆反应特点和化学平衡状态的判断

练习册系列答案
相关题目
对于100mL 1mol/L盐酸与锌粒的反应,采取下列措施能使反应速率加快的是①升高温度;②改用100mL 3mol/L盐酸;③改用300mL 1mol/L盐酸;④用等量锌粉代替锌粒;⑤滴入少量CuSO4溶液
| A.①②④⑤ | B.①③④⑤ | C.①②③④ | D.①②④ |
下列有关说法正确的是
| A.铅蓄电池在放电时,两极质量均增加 |
| B.钢铁在中性溶液中主要发生析氢腐蚀 |
| C.在室温下能自发进行的反应,其△H一定小于0 |
| D.0.1 mol·L-1Na2S溶液加水稀释时,n(Na+)/n(S2-)值将减小 |
工业制硫酸中的一步重要反应是SO2(在400-500 C下的催化氧化:2SO2+O2
C下的催化氧化:2SO2+O2 2SO3,这是一个正反应放热的可逆反应,如果反应在密闭容器中进行,下述有关说法错误的是
2SO3,这是一个正反应放热的可逆反应,如果反应在密闭容器中进行,下述有关说法错误的是
| A.在上述条件下,SO2可能100%的转化为SO3 |
| B.使用催化剂是为了加快反应速率,提高生产效率 |
| C.达到平衡时,SO2与SO3的浓度保持不变 |
| D.为了提高SO2的转化率,可以适当提高O2的浓度 |
汽车尾气中的有毒气体NO和CO,在一定条件下可发生反应生成N2和CO2。下列关于此反应的说法中,正确的是( )
| A.减小压强能增大反应速率 | B.增大压强能减小反应速率 |
| C.使用适当的催化剂能增大反应速率 | D.升高温度对反应速率无影响 |
在容积一定的密闭容器中,反应2A B(g)+C(g)达到平衡后,升高温度容器内气体的密度增大,则下列叙述正确的是 ( )
B(g)+C(g)达到平衡后,升高温度容器内气体的密度增大,则下列叙述正确的是 ( )
| A.正反应是放热反应,且A是气态 |
| B.正反应是吸热反应,且A不是气态 |
| C.其他条件不变,加入少量A,该平衡向正反应方向移动 |
| D.改变压强对该平衡的移动无影响 |
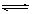 2C(g)(正反应吸热),下列图象中正确的是
2C(g)(正反应吸热),下列图象中正确的是