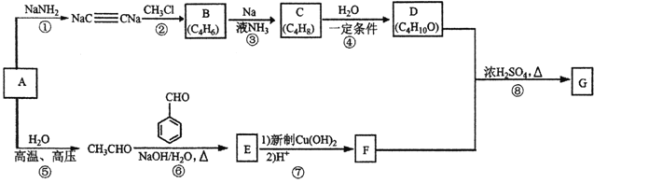
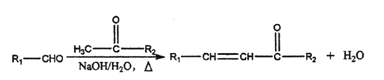
题目内容
【题目】现有A、B、C、D、E五种短周期元素,已知A、B、C、D四种元素的核内质子数之和为56,在元素周期表中的位置如图所示,1 mol E的单质可与足量酸反应,能产生33.6 L H2(在标准状况下);E的阳离子与A的阴离子核外电子层结构相同。
A | ||
B | C | D |
回答下列问题:
(1)写出下列元素名称A__________,B___________,E____________
(2)C的简单离子结构示意图为_____________。
(3)B单质在A单质中燃烧,生成物的化学式为___________。
(4)A与E形成的化合物的化学式为__________,它的性质决定了它在物质的分类中应属于____。
(5)向D与E形成的化合物的水溶液中滴入烧碱溶液至过量,此过程中观察到的现象是_______,写出有关化学反应方程式_______。
【答案】氧 磷 铝 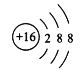 P2O5 Al2O3 两性氧化物 先产生白色沉淀,继续滴加,白色沉淀溶解 AlCl3+3NaOH=Al(OH)3↓+3NaCl;Al(OH)3 + NaOH = NaAlO2 + 2H2O
P2O5 Al2O3 两性氧化物 先产生白色沉淀,继续滴加,白色沉淀溶解 AlCl3+3NaOH=Al(OH)3↓+3NaCl;Al(OH)3 + NaOH = NaAlO2 + 2H2O
【解析】
设C的序数为x,则A为x-8,B为x-1,D为x+1,所以x+ x-8+ x-1+ x+1=56 , x=16,则A为氧,B为磷, C为硫, D为氯。1molE 的单质可与足量酸反应,能产生33.6 L H2, 33.6 L H2为1.5mol,所以E失去三个电子转化为阳离子,E的离子与O2-核外电子层结构相同,故E为铝。
(1)根据分析,A是氧,B是磷,E是铝;本题要求写元素名称,故不能写元素符号;
(2)S2-结构示意图为 ;
;
(3)P在O2中燃烧:4P+5O2![]() 2P2O5,生成P2O5;
2P2O5,生成P2O5;
(4)氧元素与铝元素形成的化合物的化学式为Al2O3,因为既能与酸反应生成相应的盐和水,又可以与碱反应生成相应的盐和水,所以属于两性氧化物;
(5)向AlCl3溶液中滴入烧碱溶液,先生成Al(OH)3白色沉淀,滴加至过量,生成的氢氧化铝会溶解,生成NaAlO2 ,所以此过程中观察到的现象是先出现白色沉淀,后白色沉淀消失;有关反应方程式AlCl3+3NaOH=Al(OH)3↓+3NaCl;Al(OH)3 + NaOH = NaAlO2 + 2H2O;

【题目】(CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。
已知反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)![]() FeO(s)+H2(g)的平衡常数为K2。
FeO(s)+H2(g)的平衡常数为K2。
在不同温度时K1、K2的值如下表:
温度(绝对温度) | K1 | K2 |
973 | 1.47 | 2.38 |
1173 | 2.15 | 1.67 |
(1)写出K2表达式:____。
(2)推导反应CO2(气)+H2(气)![]() CO(气)+H2O(气)的平衡常数K与K1、K2的关系式:__,判断该反应是__反应(填“吸热”或“放热”)。
CO(气)+H2O(气)的平衡常数K与K1、K2的关系式:__,判断该反应是__反应(填“吸热”或“放热”)。
(3)在体积为10L的密闭容器中,加入一定量的CO2和H2(气),在1173K时发生反应CO2(气)+H2(气)![]() CO(气)+H2O(气)并记录前5min的浓度,第6min时改变了反应的条件。各物质的浓度变化如下表:
CO(气)+H2O(气)并记录前5min的浓度,第6min时改变了反应的条件。各物质的浓度变化如下表:
时间/min | CO2(mol/L) | H2(mol/L) | CO(mol/L) | H2O(mol/L) |
0 | 0.2000 | 0.3000 | 0 | 0 |
2 | 0.2740 | 0.0260 | 0.0260 | |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | c3 |
5 | 0.0727 | 0.1727 | 0.1273 | 0.1273 |
6 | 0.0350 | 0.1350 | 0.1650 |
①前2min,用CO表示的该化学反应的速率是:_____。
②在0~5min之间,达平衡时CO2的转化率为____。
③第6min时,平衡向____方向(填“正反应”或“逆反应”)移动,可能的原因是___。
【题目】乙酰苯胺是一种具有退热镇痛作用的药物,可用苯胺和冰醋酸为原料来制备乙酰苯胺。
①化学原理为: (已知:苯胺易被氧化)
(已知:苯胺易被氧化)
②相关物质的物理常数
物质 | 相对分子质量 | 状态 | 熔点(℃) | 沸点(℃) | 溶解度(g) | |
水 | 乙醇 | |||||
苯胺 | 93 | 无色液体 | 6 | 184 | 3.42(20℃) | 任意比混溶 |
冰醋酸 | 60 | 无色液体 | 17 | 118 | 任意比混溶 | 任意比混溶 |
乙酰苯胺 | 135 | 白色片状固体 | 114 | 304 | 0.56(20℃)、3.45(50℃)、5.20(100℃) | 36.9(20℃) |
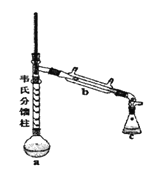
③制各乙酰苯胺的装置如图所示:韦氏分馏柱作用与原理类似于冷凝管。
④制备方法和过程:

(1)仪器a的名称_______。
(2)制备过程中加入锌粒的作用:其一是________、其二是防止暴沸。
(3)从化学平衡的角度分析,步骤1要控制分馏柱上端的温度在105℃左右的原因_____。
(4)步骤2
(5)步骤3中洗涤剂最好选择________。
A.冷水 B.热水 C.15%的乙醇溶液 D.NaOH溶液
(6)步骤4重结晶的过程:粗产品溶于沸水中配成饱和溶液→再加入少量蒸馏水→加入活性炭脱色→加热煮沸→_____→冷却结晶→过滤→洗涤→干燥。
(7)本实验所得到的乙酰苯胺产率是________。