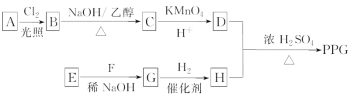
题目内容
【题目】下列事实中,能用勒夏特列原理解释的是( )
A. 由H2、I2、HI三种气体组成的平衡体系加压后颜色变深
B. 对2SO2+O2![]() 2SO3 △H<0的反应,使用催化剂可加快反应的速率
2SO3 △H<0的反应,使用催化剂可加快反应的速率
C. 实验室可用浓氨水和氢氧化钠固体快速制取氨气
D. N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0,500 ℃左右比室温更有利于合成NH3
2NH3(g) ΔH<0,500 ℃左右比室温更有利于合成NH3
【答案】C
【解析】
依据勒夏特列原理的内涵和外延进行分析;
A、H2与I2的反应:H2(g)+I2(g) ![]() 2HI(g),反应前后气体分子数之和相等,增大压强,平衡不移动,但组分浓度增大,颜色变深,不能用勒夏特列原理解释,故A不符合题意;
2HI(g),反应前后气体分子数之和相等,增大压强,平衡不移动,但组分浓度增大,颜色变深,不能用勒夏特列原理解释,故A不符合题意;
B、催化剂对化学平衡移动无影响,不能用勒夏特列原理解释,故B不符合题意;
C、浓氨水中存在NH3·H2O![]() NH4++OH-,加入NaOH固体,溶液中c(OH-)促使平衡向逆反应方向移动,NH3·H2O浓度增大,NaOH固体与水放出热量,促使NH3·H2O分解,能用勒夏特列原理解释,故C符合题意;
NH4++OH-,加入NaOH固体,溶液中c(OH-)促使平衡向逆反应方向移动,NH3·H2O浓度增大,NaOH固体与水放出热量,促使NH3·H2O分解,能用勒夏特列原理解释,故C符合题意;
D、该反应为放热反应,升高温度,平衡向逆反应方向移动,不利于合成氨,500℃是催化剂催化效率最高的适宜温度,不能用勒夏特列原理解释,故D不符合题意。

 世纪百通期末金卷系列答案
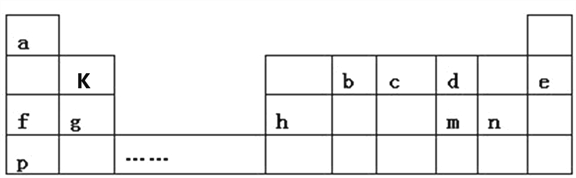
世纪百通期末金卷系列答案【题目】现有A、B、C、D、E五种短周期元素,已知A、B、C、D四种元素的核内质子数之和为56,在元素周期表中的位置如图所示,1 mol E的单质可与足量酸反应,能产生33.6 L H2(在标准状况下);E的阳离子与A的阴离子核外电子层结构相同。
A | ||
B | C | D |
回答下列问题:
(1)写出下列元素名称A__________,B___________,E____________
(2)C的简单离子结构示意图为_____________。
(3)B单质在A单质中燃烧,生成物的化学式为___________。
(4)A与E形成的化合物的化学式为__________,它的性质决定了它在物质的分类中应属于____。
(5)向D与E形成的化合物的水溶液中滴入烧碱溶液至过量,此过程中观察到的现象是_______,写出有关化学反应方程式_______。