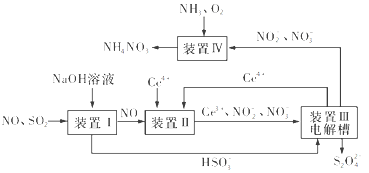
题目内容
【题目】常温下,对下列电解质溶液的有关说法正确的是
A. 相同浓度和体积的强碱和强酸溶液混合后,溶液的pH一定等于7
B. 在NaHCO3溶液中,c(CO32-)>c(HCO3-)
C. 在AgCl悬浊液中加入NaCl固体,c(Ag+)减小
D. 将pH相等的CH3COONa和NaOH溶液稀释相同倍数后,溶液的pH:CH3COONa<NaOH
【答案】C
【解析】
A.若是二元强酸与一元强碱或一元强酸与二元强碱相同浓度和体积混合后,溶液中的H+或OH-没有被完全中和,则溶液的pH就不等于7,A错误;
B.在NaHCO3溶液中,HCO3-的电离或水解程度都是微弱的,主要以HCO3-的形式存在,所以离子浓度c(HCO3-)>c(CO32-),B错误;
C.在AgCl悬浊液中存在沉淀溶解平衡:AgCl(s)![]() Ag+(aq)+Cl-(aq),加入NaCl固体后,溶液中c(Cl-)增大,沉淀溶解平衡逆向移动,最终导致溶液中c(Ag+)减小,C正确;
Ag+(aq)+Cl-(aq),加入NaCl固体后,溶液中c(Cl-)增大,沉淀溶解平衡逆向移动,最终导致溶液中c(Ag+)减小,C正确;
D. CH3COONa水解使溶液显碱性,在溶液中存在水解平衡,加水稀释,水解平衡正向移动,使溶液中c(OH-)减小的倍数小于稀释倍数,而NaOH是强碱,完全电离,加水稀释,c(OH-)减小,c(OH-)减小的倍数等于稀释的倍数,所以将pH相等的CH3COONa和NaOH溶液稀释相同倍数后,溶液的pH:CH3COONa>NaOH,D错误;
故合理选项是C。

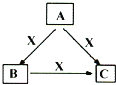
【题目】现有A、B、C、D、E五种短周期元素,已知A、B、C、D四种元素的核内质子数之和为56,在元素周期表中的位置如图所示,1 mol E的单质可与足量酸反应,能产生33.6 L H2(在标准状况下);E的阳离子与A的阴离子核外电子层结构相同。
A | ||
B | C | D |
回答下列问题:
(1)写出下列元素名称A__________,B___________,E____________
(2)C的简单离子结构示意图为_____________。
(3)B单质在A单质中燃烧,生成物的化学式为___________。
(4)A与E形成的化合物的化学式为__________,它的性质决定了它在物质的分类中应属于____。
(5)向D与E形成的化合物的水溶液中滴入烧碱溶液至过量,此过程中观察到的现象是_______,写出有关化学反应方程式_______。