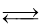
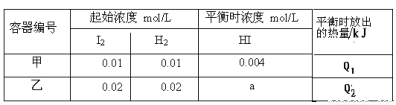
题目内容
四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法正确的是
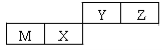
A.原子半径Z > Y
B.X 的最简单气态氢化物的热稳定性比Z的小
C.Y的最高价氧化物对应水化物的酸性比X 的弱
D.M的最高价氧化物对应水化物不能与NaOH溶液反应
B
【解析】
试题分析:A、M为金属,根据四种短周期元素的位置判断M是Al元素,X、Y、Z分别是Si、N、O元素。YZ同周期,所以Y的原子半径大于Z的原子半径,错误;B、Si的非金属性弱于O的非金属性,所以Si最简单气态氢化物的热稳定性比O的小,正确;C、N的最高价氧化物对应水化物是硝酸,而O不存在最高价氧化物对应水化物,错误;D、M的最高价氧化物对应水化物是氢氧化铝,可以与氢氧化钠溶液反应,错误,答案选B。
考点:考查对元素周期表的认知程度,元素的判断,元素周期律的应用

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案(15分)
某研究小组想研究碳与浓硝酸的反应。其实验过程如下。
操作 | 现象 |
|
|
b.把小块烧红的木炭迅速伸入热的浓硝酸中。 | 红热的木炭与热的浓硝酸接触发生剧烈反应,同时有大量红棕色气体产生,液面上木炭迅速燃烧,发出光亮。 |
(1)热的浓硝酸与红热的木炭接触会发生多个化学反应。
① 碳与浓硝酸的反应,说明浓硝酸具有 性。
② 反应产生的热量会使少量浓硝酸受热分解,产生红棕色气体、一种无色无味的单质气体X和水,气体X的化学式是 。
(2)实验现象中液面上木炭迅速燃烧,发出光亮。同学甲认为可能是木炭与气体X反应产生的现象;同学乙猜测NO2可能具有助燃性,木炭能在NO2中燃烧。他们设计了以下实验。
Ⅰ.制取NO2气体。
① 在虚线框内画出用铜与浓硝酸制取和收集NO2的装置简图(夹持仪器略)。
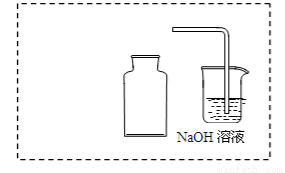
② NaOH溶液的作用是吸收多余的NO2,该反应生成两种物质的量相等的正盐,写出反应的化学方程式 。
Ⅱ.探究实验。
实验操作:在空气中引燃木炭,使其燃烧并带有火焰,将带火焰的木炭伸入盛有NO2气体的集气瓶中。
实验现象:木炭在NO2气体中持续燃烧,火焰迅速变亮,集气瓶中气体颜色变浅直至无色,产生的气体能使澄清石灰水变浑浊,且遇空气不变色。
① 根据实验现象写出碳与NO2气体反应的化学方程式 。
② 试分析是否需要增加带火焰的木炭与纯净的X气体反应的实验 。
③ 通过实验探究,你认为甲、乙同学的预测是否合理,请简述理由 。
下列离子组在一定条件下能大量共存,当加入相应试剂后会发生化学变化,且所给离子方程式正确的是 ( )
选项 | 离子组 | 加入试剂 | 加入试剂后发生反应的离子方程式 |
A | Fe2+、NO | 稀硫酸 | 3Fe2++NO |
B | Fe3+、I-、ClO- | 氢氧化钠溶液 | Fe3++3OH-=Fe(OH)3↓ |
C | Ba2+、HCO | 氢氧化钠溶液 | HCO |
D | Al3+、Cl-、NO | 过量氢氧化钠溶液 | Al3++3 OH-=Al(OH)3↓ |