题目内容
恒温下,在容积为1升的甲、乙两个恒容密闭容器中分别充入H2和I2发生可逆
H2(g) +I2(g) 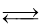 2HI(g) ΔH = -14.9 kJ/mol,实验时有关数据如下表:
2HI(g) ΔH = -14.9 kJ/mol,实验时有关数据如下表:
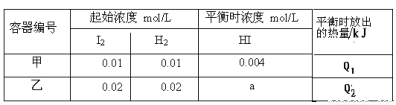
下列判断正确的
A.平衡时,乙中颜色更深,a>0.008
B.平衡时,放出的热量:Q1=1/2Q2 =0.149kJ
C.该温度下,该反应的平衡常数K=4
D.平衡后,向甲中再冲入0.004 mol HI气体,再次达到平衡时HI的百分含量不变
D
【解析】
试题分析:A、乙容器的反应物浓度是甲容器反应物浓度的2倍,该反应是反应前后气体物质的量不变的可逆反应,所以恒温恒容时,压强的改变对该反应无影响,因此达平衡时乙容器的HI的浓度是甲容器HI的2倍,颜色加深但a=0.008,错误;B、可逆反应的反应物不会完全转化,所以平衡时,放出的热量:Q1=1/2Q2<0.149kJ,错误;C、该温度下,该反应的平衡常数K=0.0042/0.001×0.001=16,错误;D、平衡后,向甲中再冲入0.004 mol HI气体,相当于又增加了0.002mol的H2、I2,其物质的量比与开始时相同都为1:1,所以再达平衡时与原平衡等效,HI的百分含量不变,正确,答案选D。
考点:考查同一可逆反应不同条件的平衡的比较,等效平衡的判断

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案(14分)甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。
操 作 | 现 象 |
通入氯气至过量
| I.A中溶液变红 II.稍后,溶液由红色变为黄色
|
(1)B中反应的离子方程式是______。
(2)A中溶液变红的原因是______。
(3)为了探究现象II的原因,甲同学进行如下实验。
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在_______。
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液。
甲同学的实验证明产生现象II的原因是SCN—与Cl2发生了反应。
(4)甲同学猜想SCN—可能被Cl2氧化了,他又进行了如下研究。
资料显示:SCN—的电子式为  。
。
①甲同学认为SCN—中碳元素没有被氧化,理由是______。
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN—中被氧化的元素是______。
③通过实验证明了SCN—中氮元素转化为,他的实验方案是______。
④若SCN—与Cl2反应生成1 mol CO2,则转移电子的物质的量是______mol。



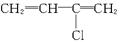 (聚合成氯丁橡胶)
(聚合成氯丁橡胶)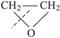 在虚线处开环聚合得?CH2—CH2—O?(作表面活性剂),则
在虚线处开环聚合得?CH2—CH2—O?(作表面活性剂),则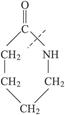 开环聚合得的高聚物是什么?(此聚合物作合成纤维)。
开环聚合得的高聚物是什么?(此聚合物作合成纤维)。