题目内容
【题目】工业生产硫酸中二氧化硫的催化氧化原理为:2SO2(g)+O2(g)![]() 2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是
2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是
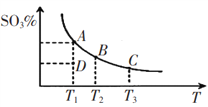
A. 在A、B、C三点时,V(正)=v(逆),在D点时V(正)>v(逆)
B. A、B、C三点的平衡常数一定不相同
C. 升高温度可以加快化学反应速率,有利于平衡向正反应方向移动
D. 一定温度下,保持容器体积不变,向平衡体系中通人稀有气体,压强增大,平衡不移动
【答案】C
【解析】试题分析:A.曲线上的点为平衡点,则A、B、C三点时v(正)=v(逆),D点SO3的百分含量小于平衡时含量,向正反应方向移动,D点时v(正)>v(逆),故A正确;B.A、B、C三点的温度不同,则平衡常数一定不相同,故B正确;C.由图可知,温度越高,生成物的含量越低,该反应为放热反应,升高温度可以加快化学反应速率,但平衡向逆反应方向移动,故C错误;D.容器体积不变,向平衡体系中通入稀有气体,反应体系中各物质的浓度不变,则平衡不移动,故D正确;故选C。

练习册系列答案
相关题目
【题目】一定温度下,在2L密闭容器中加入纳米级Cu2O并通入0.1mol H2O(g),发生反应:2H2O(g)![]() 2H2(g)+O2(g)△H=+484kJmol﹣1,不同时间产生O2的物质的量见下表:
2H2(g)+O2(g)△H=+484kJmol﹣1,不同时间产生O2的物质的量见下表:
时间/min | 20 | 40 | 60 | 80 |
n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |
下列说法不正确的是( )
A、前20 min内的反应速率v(H2O)=5.0×10-5 molL﹣1min﹣1
B、达到平衡时,至少需要从外界吸收能量0.968 kJ
C、增大c(H2O),可以提高水的分解率
D、催化效果与Cu2O颗粒的大小有关