题目内容
某温度下将1molN2和2.5molH2的混合气体通入1L密闭容器中,在一定条件下发生反应,达到化学平衡时,测得混合气体中N2的物质的量为0.2mol.求:
(1)平衡时N2的转化率.
(2)此温度下反应N2(g)+3H2(g)?2NH3(g)的平衡常数.
(1)平衡时N2的转化率.
(2)此温度下反应N2(g)+3H2(g)?2NH3(g)的平衡常数.
依据化学平衡三段式列式计算;
N2(g)+3H2(g)?2NH3(g)
起始量(mol)12.50
变化量(mol) 0.82.41.6
平衡量(mol) 0.20.11.6
(1)平衡时N2的转化率为:
×100%=80%,
答:平衡时氮气的转化率为80%;
(2)平衡浓度c(N2)=0.2mol/L、c(H2)=0.1mol/L、c(NH3)=1.6mol/L,
平衡常数K=
=
=12800(L/mol)2;
答:此温度下反应的平衡常数为12800.
N2(g)+3H2(g)?2NH3(g)
起始量(mol)12.50
变化量(mol) 0.82.41.6
平衡量(mol) 0.20.11.6
(1)平衡时N2的转化率为:
| 0.8mol |
| 1mol |
答:平衡时氮气的转化率为80%;
(2)平衡浓度c(N2)=0.2mol/L、c(H2)=0.1mol/L、c(NH3)=1.6mol/L,
平衡常数K=
| C2(NH3) |
| C(N2)C3(H2) |
| 1.62 |
| 0.2×0.13 |
答:此温度下反应的平衡常数为12800.

练习册系列答案
相关题目
 2HI(g)
2HI(g)
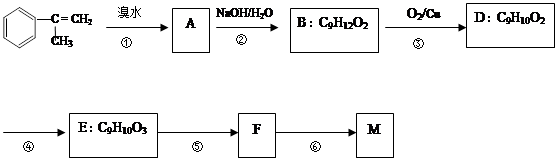
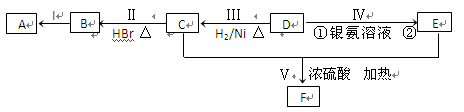
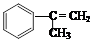 出发来合成M,其合成路线如下:
出发来合成M,其合成路线如下: