题目内容
(16分)
I.由C、H、O三种元素组成的有机物R,R的相对分子质量122,其中含碳元素的质量分数为68.9%,含氧元素的质量分数为26.2%。R与NaHCO3溶液反应,生成的气体能使澄清石灰水变浑浊。则R的分子式是____________________。
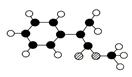
II.M是生产某新型塑料的基础原料之一,分子式为C10H10O2,其分子结构模型如图所示(图中球与球之间连线代表化学键单键或双键等)。
拟从芳香烃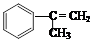 出发来合成M,其合成路线如下:
出发来合成M,其合成路线如下:
已知:M在酸性条件下水解生成有机物F和甲醇。
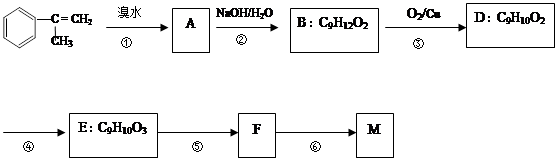
(1)M的结构简式 。
(2)写出②、⑤反应类型分别为 、 。
(3)D中含氧官能团的名称为 ,E的结构简式 。(4)写出反应⑥的化学方程式(注明必要的条件):
。
(5)写出符合下列两个条件的结构简式:①与F互为同分异构体;②能发生水解反应,水解产物有两种,一种能使溴的四氯化碳溶液褪色,另一种滴加FeCl3溶液显紫色。 。
I.由C、H、O三种元素组成的有机物R,R的相对分子质量122,其中含碳元素的质量分数为68.9%,含氧元素的质量分数为26.2%。R与NaHCO3溶液反应,生成的气体能使澄清石灰水变浑浊。则R的分子式是____________________。
II.M是生产某新型塑料的基础原料之一,分子式为C10H10O2,其分子结构模型如图所示(图中球与球之间连线代表化学键单键或双键等)。

拟从芳香烃
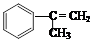 出发来合成M,其合成路线如下:
出发来合成M,其合成路线如下:已知:M在酸性条件下水解生成有机物F和甲醇。

(1)M的结构简式 。
(2)写出②、⑤反应类型分别为 、 。
(3)D中含氧官能团的名称为 ,E的结构简式 。(4)写出反应⑥的化学方程式(注明必要的条件):
。
(5)写出符合下列两个条件的结构简式:①与F互为同分异构体;②能发生水解反应,水解产物有两种,一种能使溴的四氯化碳溶液褪色,另一种滴加FeCl3溶液显紫色。 。
I.C7H6O2
II.(1)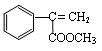 (2分)
(2分)
(2)取代(水解)反应、消去反应(各2分,共4分)
(3)醛基、(醇)羟基(各1分,共2分) (2分)
(2分)
(4) (2分)
(2分)
(5) -OOCCH=CH2(2分)
-OOCCH=CH2(2分)
II.(1)
 (2分)
(2分)(2)取代(水解)反应、消去反应(各2分,共4分)
(3)醛基、(醇)羟基(各1分,共2分)
 (2分)
(2分)(4)
 (2分)
(2分)(5)
 -OOCCH=CH2(2分)
-OOCCH=CH2(2分)I.分子中含碳和氧原子的个数分别是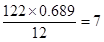 、
、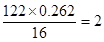 ,所以氢原子的个数是
,所以氢原子的个数是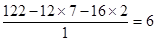 ,因此其分子式为C7H6O2。
,因此其分子式为C7H6O2。
II.(1)根据M的分子结构模型可知,其结构简式为 。
。
(2)反应①是碳碳双键的加成反应,即A的结构简式为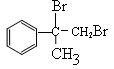 。A在氢氧化钠的水溶液中水解生成B,所以反应②是水解反应,B的结构简式为
。A在氢氧化钠的水溶液中水解生成B,所以反应②是水解反应,B的结构简式为 。B发生催化氧化生成D,所以D的结构简式为
。B发生催化氧化生成D,所以D的结构简式为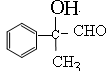 。D继续氧化生成E,则E的结构简式为
。D继续氧化生成E,则E的结构简式为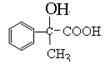 .:M在酸性条件下水解生成有机物F和甲醇,所以F的结构简式为
.:M在酸性条件下水解生成有机物F和甲醇,所以F的结构简式为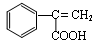 。
。
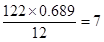 、
、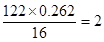 ,所以氢原子的个数是
,所以氢原子的个数是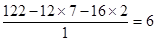 ,因此其分子式为C7H6O2。
,因此其分子式为C7H6O2。II.(1)根据M的分子结构模型可知,其结构简式为
 。
。(2)反应①是碳碳双键的加成反应,即A的结构简式为
 。A在氢氧化钠的水溶液中水解生成B,所以反应②是水解反应,B的结构简式为
。A在氢氧化钠的水溶液中水解生成B,所以反应②是水解反应,B的结构简式为 。B发生催化氧化生成D,所以D的结构简式为
。B发生催化氧化生成D,所以D的结构简式为 。D继续氧化生成E,则E的结构简式为
。D继续氧化生成E,则E的结构简式为 .:M在酸性条件下水解生成有机物F和甲醇,所以F的结构简式为
.:M在酸性条件下水解生成有机物F和甲醇,所以F的结构简式为 。
。
练习册系列答案
相关题目



 ②乙烯 ③C6H12O6 (葡萄糖) ④CH3CH2OH
②乙烯 ③C6H12O6 (葡萄糖) ④CH3CH2OH ⑦聚乙烯
⑦聚乙烯