题目内容
【题目】食盐是日常生活必需品,也是重要的化工原料。
(1)某种粗盐含有少量Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯该粗盐的流程如下:
粗盐溶解![]()
![]() 滤液
滤液![]()
![]() 纯NaCl
纯NaCl
提供的试剂有:a.饱和Na2CO3溶液 b.饱和K2CO3溶液 c.NaOH溶液 d.BaCl2溶液 e.Ba(NO3)2溶液
欲除去粗盐溶液中的Ca2+、Mg2+、Fe3+、SO42-离子,需依次加入三种试剂,顺序依次为
(填序号); ;
(2)食盐是工业上生产氯气和烧碱的重要原料。下图是工业上电解饱和食盐水的离子交换膜电解槽示 意图(阳极用金属钛网制成,阴极由碳钢网制成)。
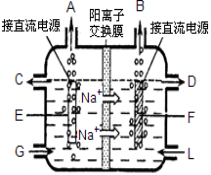
①F电极是 (填阴极或阳极);G处进口的物质是 ;
电解总反应的离子方程式为: 。
②通电几分钟后,如果将直流电源的正负极与电极接反,在电极F附近可以观察到的现象是 。
(3)采用无膜电解槽电解饱和食盐水(离子交换膜更换为搅拌器),可制取次氯酸钠溶液作消毒液,制取消毒液的离子反应方程式为 ,当收集到22.4L标准状况下的H2时,理论上所得混合溶液中次氯酸钠的质量最多为 。
【答案】(1)cda(或合理答案均可,保证a在d后面);
(2)①阴极,饱和食盐水,2Cl-+2H2O![]() Cl2↑+H2↑+2OH-;
Cl2↑+H2↑+2OH-;
②溶液中产生白色沉淀,然后迅速灰绿色,最终变为红褐色,碳钢网电极被腐蚀;
(3)2OH-+Cl2=Cl-+ClO-+H2O(或Cl-+H2O![]() ClO-+H2↑),74.5g。
ClO-+H2↑),74.5g。
【解析】
试题分析:(1)除去SO42-用BaCl2,除去Ca2+用Na2CO3,不能用K2CO3,会引入K+,除去Mg2+、Fe3+用NaOH除去,因为Na2CO3除了除去Ca2+还要除去Ba2+,因此Na2CO3必须放在BaCl2的后面,因此顺序是dac或cda或dca;(2)①根据Na+的移动方向,推出F电极为阴极,E电极为阳极,阳极反应式为2Cl--2e-=Cl2↑,消耗Cl-,因此G通入饱和食盐水,总电极反应式为2Cl-+2H2O![]() Cl2↑+H2↑+2OH-;②如果电源反接,原来的阴极变为阳极,阴极是碳钢网,铁作阳极,发生Fe - 2e- = Fe2+ ,Fe2+ + 2OH- = Fe(OH)2↓ ,4Fe(OH)2 + O2 + 2H2O = 4 Fe(OH)3,现象是:溶液中产生白色沉淀,然后迅速灰绿色,最终变为红褐色,碳钢网电极被腐蚀;(3)Cl2+2OH-=ClO-+Cl-+H2O,产生22.4L的氢气的同时产生22.4L的氯气,因此产生m(NaClO)=22.4×74.5/22.4g=74.5g。
Cl2↑+H2↑+2OH-;②如果电源反接,原来的阴极变为阳极,阴极是碳钢网,铁作阳极,发生Fe - 2e- = Fe2+ ,Fe2+ + 2OH- = Fe(OH)2↓ ,4Fe(OH)2 + O2 + 2H2O = 4 Fe(OH)3,现象是:溶液中产生白色沉淀,然后迅速灰绿色,最终变为红褐色,碳钢网电极被腐蚀;(3)Cl2+2OH-=ClO-+Cl-+H2O,产生22.4L的氢气的同时产生22.4L的氯气,因此产生m(NaClO)=22.4×74.5/22.4g=74.5g。