题目内容
【题目】(1)19g某金属氯化物ACl2中含有0.4molCl-离子,则ACl2的摩尔质量是____________, A的相对原子质量是___________。
(2)同温同压下,质量相同的五种气体:①CO2②H2③O2④CH4⑤SO2,所占体积由大到小的顺序是(填序号,下同) ; 密度由大到小的顺序是 。
(3)标准状况下,密度为0.75 g·L-1的NH3与CH4组成的混合气体的平均摩尔质量为 。
(4)VmLAl2(SO4)3溶液中含Al3+ ag,取V/4mL溶液稀释到VmL,则稀释后溶液中SO42-的物质的量浓度是 mol/L。
【答案】
(1)95g·mol-1;24;
(2)②④③①⑤;⑤①③④②;
(3)16.8g/mol;
(4)125a/9V
【解析】
试题分析:(1)19g某二价金属的氯化物ACl2中含有0.4mol Cl-,则ACl2的物质的量为0.2mol,摩尔质量=![]() =95g/mol;ACl2中A的相对原子质量=95-35.5×2=24;依据相对原子质量为24;故答案为:95g/mol;24;
=95g/mol;ACl2中A的相对原子质量=95-35.5×2=24;依据相对原子质量为24;故答案为:95g/mol;24;
(2)设质量均为mg,则物质的量分别为![]() mol、
mol、![]() mol、
mol、![]() mol、
mol、![]() mol、
mol、![]() mol,同温同压下体积与物质的量成正比,则所占的体积由大到小的顺序是②④③①⑤;由pM=ρRT可知,密度与摩尔质量成正比,即摩尔质量越大,密度越大,64>44>32>16>2,即密度由大到小的顺序为⑤①③④②,故答案为:②④③①⑤;⑤①③④②;
mol,同温同压下体积与物质的量成正比,则所占的体积由大到小的顺序是②④③①⑤;由pM=ρRT可知,密度与摩尔质量成正比,即摩尔质量越大,密度越大,64>44>32>16>2,即密度由大到小的顺序为⑤①③④②,故答案为:②④③①⑤;⑤①③④②;
(3)混合气体的平均摩尔质量=0.75g/L×22.4L/mol=16.8g/mol,故答案为:16.8g/mol;
(4)ag Al3+ 的物质的量为![]() =
=![]() mol,而n(SO42-)=
mol,而n(SO42-)=![]() n(Al3+)=
n(Al3+)=![]() mol,则
mol,则![]() mL溶液中SO42-的物质的量=
mL溶液中SO42-的物质的量=![]() mol×
mol×![]() =
=![]() mol,则
mol,则![]() mL溶液稀释到VmL,稀释后溶液中SO42-的物质的量浓度是
mL溶液稀释到VmL,稀释后溶液中SO42-的物质的量浓度是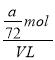 =
=![]() mol/L,故答案为:
mol/L,故答案为:![]() mol/L.
mol/L.

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案