题目内容
现有下列十种物质:①H2 ②铝 ③CaO ④CO2 ⑤H2SO4 ⑥Ba(OH)2 ⑦红褐色的氢氧化铁液体 ⑧氨水 ⑨稀硝酸 ⑩Al2(SO4)3
(1)上述各物质按物质的分类方法填写表格的空白处(填物质编号):
| 分类标准 | 金属单质 | 氧化物 | 溶液 | 胶体 | 电解质 |
| 属于该类的物质 | | | | | |
(2)上述十种物质中有两种物质之间可发生离子反应:H++OH-=H2O,该离子反应对应的化学方程式为__________________________________________________________。
(3)⑩在水中的电离方程式为_______________________________________________。
(4)少量的④通入⑥的溶液中反应的离子方程式为_______________________________。
(5)②与⑨发生反应的化学方程式为:Al + 4HNO3=Al(NO3)3 + NO↑ + 2H2O,该反应的氧化剂是____________(填化学式),氧化剂与还原剂的物质的量之比是___________,当有5.4g Al发生反应时,转移电子的物质的量为____________。该反应的离子方程式为_____________________________
(1)
| 分类标准 | 金属单质 | 氧化物 | 溶液 | 胶体 | 电解质 |
| 属于该类的物质 | ② | ③④ | ⑧⑨ | ⑦ | ③⑤⑥⑩ |
(2) Ba(OH)2 + 2HNO3=Ba(NO3)2 + 2H2O(2分) (3) Al2(SO4)3 =2Al3++ 3SO42-(2分)
(4) Ba2++2OH-+CO2 =BaCO3↓+ H2O(2分)
(5) HNO3(1分) 1︰1(1分) 0.6 mol(1分)Al + 4H++NO3- =Al3++NO↑+ 2 H2O(2分)
解析试题分析:(1)H2是非金属单质,铝是金属单质,CaO是金属氧化物,CO2是非金属氧化物,H2SO4溶于水可以电离出离子,属于电解质,Ba(OH)2于水可以电离出离子,属于电解质,红褐色的氢氧化铁液体属于胶体,氨水是氨气的水溶液,属于溶液,稀硝酸是硝酸的水溶液,属于溶液,Al2(SO4)3于水可以电离出离子,属于电解质。
(2)根据离子反应:H++OH-=H2O可知,该反应应该是强酸与强碱反应生成水与可溶性盐的反应,因此满足条件的是硝酸与氢氧化钡,化学方程式为Ba(OH)2 + 2HNO3=Ba(NO3)2 + 2H2O。
(3)硫酸铝是电解质,在水中的电离方程式为Al2(SO4)3 =2Al3++ 3SO42-。
(4)少量的④通入⑥的溶液中反应生成碳酸钡白色沉淀与水,反应的离子方程式为Ba2++2OH-+CO2 =BaCO3↓+ H2O。
(5)根据方程式Al + 4HNO3=Al(NO3)3 + NO↑ + 2H2O可知,反应中硝酸中氮元素的化合价从+5价降低到+2价,得到3个电子,因此HNO3是该反应的氧化剂;金属铝中铝元素的化合价从0价升高到+3价,失去3个电子,铝是还原剂。根据电子得失守恒可知氧化剂与还原剂的物质的量之比是1︰1;5.4g铝的物质的量=5.4g÷27g/mol=0.2mol,所以当有5.4g Al发生反应时,转移电子的物质的量为0.2mol×3=0.6mol;该反应的离子方程式为Al + 4H++NO3- =Al3++NO↑+ 2 H2O。
考点:考查物质分类、离子方程式、氧化还原反应的有关判断与计算

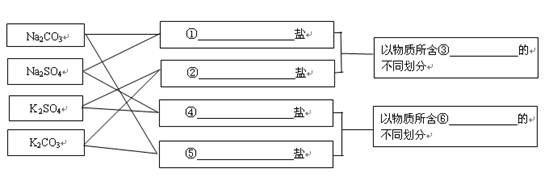
下列各组物质的分类正确的是
| A.同位素:1H+、2H2、3H |
| B.同系物:丙烷、异丁烷、新戊烷 |
| C.电解质: 冰醋酸、水银、烧碱 |
| D.酸性氧化物:一氧化氮﹑二氧化碳、三氧化硫 |
对牙膏的探究要用到许多化学知识。
(1)下表列出了三种牙膏的摩擦剂,请在表中填写三种摩擦剂所属的物质类别。
| 牙膏 | 两面针儿童牙膏 | 珍珠王防臭牙膏 | 中华透明牙膏 |
| 摩擦剂 | 氢氧化铝 | 碳酸钙 | 二氧化硅 |
| 摩擦剂的物质类别(指酸、碱、盐、氧化物、两性氢氧化物) | | | |
(2)根据你的推测,牙膏摩擦剂的溶解性是________________________
(填“易溶”或“难溶”)。
(3)牙膏中的摩擦剂碳酸钙可以用石灰石来制备,某学生设计了一种实验室制备碳酸钙的实验方案,其流程图为:
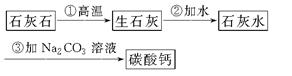
请写出上述方案中有关反应的化学方程式,并注明反应类型:
①________________________________________________;
②________________________________________________;
③________________________________________________。
(4)请你仍用石灰石作原料(其他试剂自选),设计实验室制备碳酸钙的另一种实验方案,依照(3)所示,将你的实验方案用流程图表示出来:
石灰石―→
你设计的方案的优点为:________________________________。
(5)检验牙膏中是否含有碳酸钙的实验方法是:__________________。
下列表示对应化学反应的离子方程式正确的是( )
| A.稀硝酸和过量的铁屑反应:Fe+4H++NO3-=Fe3++NO↑+2H2O |
| B.硫酸氢铵溶液中加入少量氢氧化钠溶液:NH4++OH-=NH3↑+H2O |
| C.氯化铝溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+ |
| D.Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+6H++MnO4-=5SO42-+Mn2++3H2O |
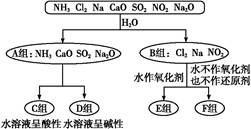
溶液中含有HCO 、SO
、SO 、Cl-和Na+,若向其中通入足量的Cl2,溶液里上述四种离子的浓度基本保持不变的是 ( )
、Cl-和Na+,若向其中通入足量的Cl2,溶液里上述四种离子的浓度基本保持不变的是 ( )
A.HCO | B.SO | C.Cl- | D.Na+ |
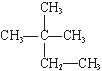 ;③白磷;④氯气;
;③白磷;④氯气; ;⑥
;⑥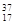 Cl;⑦
Cl;⑦ Cl;⑧红磷
Cl;⑧红磷