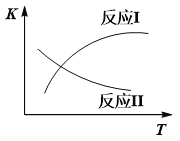
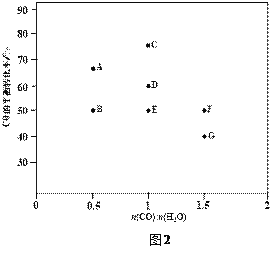
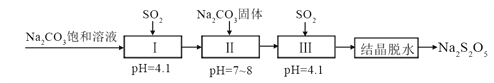
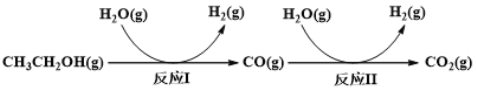题目内容
【题目】已知室温时,0.1 mol·L-1某一元酸HA在水中有0.1%发生电离,下列叙述错误的是
A. 该溶液的pH=4
B. 升高温度,溶液的pH增大
C. 此酸溶液的KW=1.0×10-14 mol2·L2-
D. 若HB+NaA=HA+NaB能进行,则Ka(HB)>Ka(HA)
【答案】B
【解析】
A项,已知0.1 mol·L-1某一元酸HA在水中有0.1%发生电离![]() ,则pH=4,故A项正确;B项,升高温促进电离,溶液中的C(H+)浓度增大,pH减小,故B项错误;C. 任何溶液中都存在着水的离子积,室温时水的离子积常数为: KW=1.0×10-14 mol2·L2-故C正确;D项.若HB+NaA=HA+NaB能进行说明HB的酸性比HA强,HB的电离程度比HA,大,所以相同温度下Ka(HB)>Ka(HA)故D正确;综上所述,本题正确答案为B。
,则pH=4,故A项正确;B项,升高温促进电离,溶液中的C(H+)浓度增大,pH减小,故B项错误;C. 任何溶液中都存在着水的离子积,室温时水的离子积常数为: KW=1.0×10-14 mol2·L2-故C正确;D项.若HB+NaA=HA+NaB能进行说明HB的酸性比HA强,HB的电离程度比HA,大,所以相同温度下Ka(HB)>Ka(HA)故D正确;综上所述,本题正确答案为B。

练习册系列答案
相关题目