题目内容
【题目】氢气是一种理想的绿色能源。利用生物质发酵得到的乙醇制取氢气,具有良好的应用前景。乙醇水蒸气重整制氢的部分反应过程如下图所示:
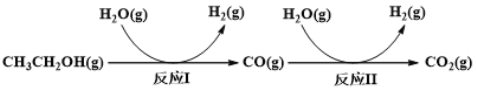
已知:反应I和反应II的平衡常数随温度变化曲线如下图所示。
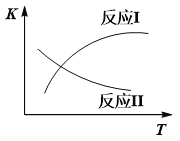
(1)①试说明反应Ⅰ能否发生自发反应______________________________________。
②反应Ⅰ、Ⅱ达平衡后,若在恒温恒压条件下,向体系中充入N2,CO的体积分数会________________(填“上升”、“不变”、“下降”)。
(2)反应II,在进气比[n(CO) : n(H2O)]不同时,测得相应的CO的平衡转化率见下图1

(各点对应的反应温度可能相同,也可能不同)。
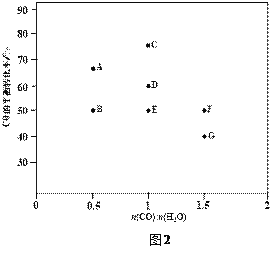
③图中D、E两点对应的反应温度分别为TD和TE。判断:TD______TE(填“<”“=”或“>”)。
④经分析计算,A、E和G三点对应的反应温度相同,理由是_________________________。
⑤在图2中,画出D点所对应温度下CO平衡转化率随进气比[n(CO) : n(H2O)]的曲线。____________
⑥以熔融Na2CO3为电解质的乙醇燃料电池具有广泛的应用,写出其负极的电极反应方程式。________________________________。
【答案】 反应ⅠCH3CH2OH+H2O→2CO+4H2 ,△S>0,根据化学平衡常数与温度的关系可知△H>0 ,高温下可自发 上升 < 经计算,A、E、G三点平衡常数相同,故反应温度相同 趋势正确,且必须穿过F、G之间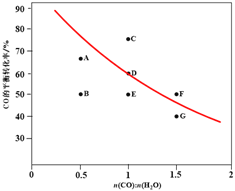 C2H5OH - 6e- + 3CO32- = 5CO2 + 3H2O
C2H5OH - 6e- + 3CO32- = 5CO2 + 3H2O
【解析】(1)①反应ⅠCH3CH2OH+H2O→2CO+4H2 ,△S>0,根据化学平衡常数与温度的关系可知△H>0 ,高温下可自发。
②在恒温恒压条件下,向体系中充入N2相当于增大了容器的体积,有利于反应Ⅰ正向移动,反应II平衡不移动,CO的体积分数会增大。
(2)③已知CO(g)+H2O(g)CO2(g)+H2(g) △H=42kJmol1,反应为放热反应,升温平衡逆向进行,CO转化率减小,图中D.E两点对应的反应温度分别为TD和TE.D点CO转化率大于E点CO转化率,说明TD<TE,故答案为:<;
④E点平衡常数CO(g)+H2O(g)CO2(g)+H2(g)
起始量1100
变化量0.50.50.50.5
平衡量0.50.50.50.5
K=1
A点平衡常数CO(g)+H2O(g)CO2(g)+H2(g)
起始量1200
变化23232323
平衡13432323
K=1
G点平衡常数CO(g)+H2O(g)CO2(g)+H2(g)
起始量3200
变化量1.21.21.21.2
平衡量1.80.8121.2
K=1.2×1.2/1.8×0.8=1,
经计算,A、E、G三点平衡常数相同,故反应温度相同
⑤趋势正确,且必须穿过F、G之间
⑥负极为乙醇失电子的反应,电极反应为:C2H5OH - 6e- + 3CO32- = 5CO2 + 3H2O

 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案


