题目内容
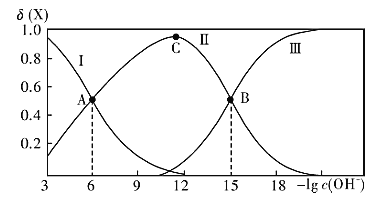
【题目】将浓度均为0.5mol·L-1的氨水和KOH溶液分别滴入到两份均为20mLc1mol·L-1的AlCl3溶液中,测得溶液的导电率与加入碱的体积关系如图所示。下列说法正确的是
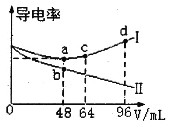
A.c1=0.2
B.b点时溶液的离子浓度:c(C1-)>c(NH4+)>c(OH-)>c(H+)
C.ac段发生的反应为:A1(OH)3+OH-==[Al(OH)4]-
D.d点时溶液中:c(K+)+c(H+)==[Al(OH)4]-+c(OH-)
【答案】C
【解析】
导电率与离子浓度成正比,向AlCl3溶液中分别加入氨水和KOH溶液,分别生成Al(OH)3和NH4Cl、Al(OH)3和KCl,当AlCl3完全反应时继续滴加碱,Al(OH)3和KOH反应生成可溶性的KAl(OH)4,一水合氨和Al(OH)3不反应,且一水合氨是弱电解质,则一水合氨溶液导电率较小,所以导电率变化较大的是氨水滴定曲线、变化较小的是KOH滴定曲线,则I为KOH滴定曲线;
A.当AlCl3和KOH恰好完全反应生成Al(OH)3和KCl时,溶液中离子浓度最小,导电率最低,则c点二者恰好完全反应,AlCl3+3KOH=Al(OH)3↓+3KCl,则n(AlCl3):n(KOH)=[c1mol·L-1×20mL]:(0.5mol·L-1×48mL)=1:3,c1=0.4,故A错误;
B.b点溶质为Al(OH)3和NH4Cl,NH4+水解导致溶液呈酸性,则c(OH-)<c(H+),故B错误;
C.ac段为Al(OH)3和KOH的反应,离子方程式为Al(OH)3+OH-═[Al(OH)4]-,故C正确;
D.d点溶液中溶质为KOH、KAl(OH)4、KCl,溶液中存在电荷守恒c(K+)+c(H+)═[Al(OH)4]-+c(OH-)+c(Cl-),故D错误;
故选:C。

【题目】扁桃酸是唯一具有脂溶性的果酸,实验室用如下原理制备:
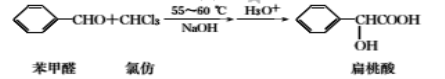
合成扁桃酸的实验步骤、装置示意图及相关数据如下:
物质 | 状态 | 熔点/℃ | 沸点/℃ | 溶解性 |
扁桃酸 | 无色透明晶体 | 119 | 300 | 易溶于热水、乙醚和异丙醇 |
乙醚 | 无色透明液体 | -116.3 | 34.6 | 溶于低碳醇、苯、氯仿,微溶于水 |
苯甲醛 | 无色液体 | -26 | 179 | 微溶于水,能与乙醇、乙醚、苯、 氯仿等混溶 |
氯仿 | 无色液体 | -63.5 | 61.3 | 易溶于醇、醚、苯、不溶于水 |
实验步骤:
步骤一:向如图所示的实验装置中加入0.1mol(约l0.1mL)苯甲醛、0.2mol(约16mL)氯仿,慢慢滴入含19g氢氧化钠的溶液,维持温度在55~60℃,搅拌并继续反应1h,当反应液的pH接近中性时可停止反应。
步骤二:将反应液用200mL水稀释,每次用20mL。乙醚萃取两次,合并醚层,待回收。
步骤三:水相用50%的硫酸酸化至pH为2~3后,再每次用40mL乙醚分两次萃取,合并萃取液并加入适量无水硫酸钠,蒸出乙醚,得粗产品约11.5g。
请回答下列问题:
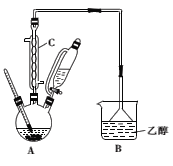
(1)图中仪器C的名称是___。
(2)装置B的作用是___。
(3)步骤一中合适的加热方式是___。
(4)步骤二中用乙醚的目的是___。
(5)步骤三中用乙醚的目的是___;加入适量无水硫酸钠的目的是___。
(6)该实验的产率为___(保留三位有效数字)。
【题目】如图所示,x、y分别是直流电源的两极,通电后发现a极极板处有无色、无味的气体放出,b极极板质量增加,符合这一情况的是( )
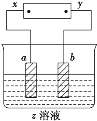
选项 | a极板 | b极板 | x电极 | z溶液 |
A | 锌 | 石墨 | 正极 | CuSO4 |
B | 石墨 | 石墨 | 负极 | NaOH |
C | 石墨 | 银 | 正极 | AgNO3 |
D | 铜 | 石墨 | 负极 | CuCl2 |
A.AB.BC.CD.D