题目内容
【题目】A、B、C、D、E五种物分别是NaOH、NH3·H2O、CH3COOH、HCl、NH4HSO4中的一种。常温下进行下列实验:
①0.001 mol/L的A溶液pH=3;
②B溶液和D溶液显碱性,等浓度两者PH关系B< D;
③E是弱电解质。回答下列问题:
(1)D是____________溶液,判断理由是______________________。
(2)用水稀释0.1 mol·L-1 B时,溶液中随着水量的增加而减小的是________(填写序号)。
①![]() ②
②![]() ③c(H+)和c(OH-)的乘积 ④OH-的物质的量
③c(H+)和c(OH-)的乘积 ④OH-的物质的量
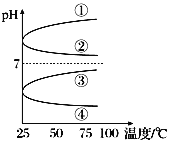
(3)将等体积、等物质的量浓度B和C的溶液混合,升高温度(溶质不会分解)溶液pH随温度变化为图中的________曲线(填写序号)。
(4)OH-浓度相同的等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是________(填写序号)。
①反应所需要的时间E>A ②开始反应时的速率A>E
③参加反应的锌的物质的量A=E ④反应过程的平均速率E>A
⑤A溶液里有锌剩余 ⑥E溶液里有锌剩余
【答案】(1)NaOH;一水合氨是一元弱碱,氢氧化钠是一元强碱,B溶液和D溶液显碱性,等浓度两者pH关系B<D,因此D是氢氧化钠 (2)①② (3)④ (4)③④⑤
【解析】
试题分析:(1)五种物质中NaOH、NH3·H2O、CH3COOH、HCl、NH4HSO4中的一种,CH3COOH、HCl、NH4HSO4均显酸性,NaOH、NH3·H2O显碱性,0.001 mol/L的A溶液pH=3,则A是盐酸;B溶液和D溶液显碱性,等浓度两者pH关系B<D,所以B是NH3·H2O,D是氢氧化钠。E是弱电解质,所以E是醋酸,则C是NH4HSO4。
(2)①由NH3·H2O![]() OH- +NH4 + 可知,加水促进电离,则n(NH3·H2O)减少,n(OH-)增大,则c(NH3H2O)/c(OH)=n(NH3H2O)/n(OH)减小,正确;②由NH3·H2O
OH- +NH4 + 可知,加水促进电离,则n(NH3·H2O)减少,n(OH-)增大,则c(NH3H2O)/c(OH)=n(NH3H2O)/n(OH)减小,正确;②由NH3·H2O![]() OH- +NH4 + 可知加水促进电离,则n(NH3·H2O)减少,n(OH-)增大,c(NH3·H2O)、c(OH-)都减小,c(H+ )增大,则c(OH)÷c(H+)减小,正确;③因加水稀释时,温度不变,则Kw=c(H+ )·c(OH)是个常数,错误;④由NH3·H2O
OH- +NH4 + 可知加水促进电离,则n(NH3·H2O)减少,n(OH-)增大,c(NH3·H2O)、c(OH-)都减小,c(H+ )增大,则c(OH)÷c(H+)减小,正确;③因加水稀释时,温度不变,则Kw=c(H+ )·c(OH)是个常数,错误;④由NH3·H2O![]() OH- +NH4 + 可知,加水促进电离,OH-的物质的量增大,错误,答案选①②;
OH- +NH4 + 可知,加水促进电离,OH-的物质的量增大,错误,答案选①②;
(3)NH3·H2O是碱,pH>7,NH4 HSO4电离产生H+,使溶液显酸性,pH<7,等体积、等物质的量浓度NH3·H2O和与NH4 HSO4 混合后溶液发生反应:NH3·H2O+ NH4 HSO4 =(NH4 )2 SO4 +H2 O,(NH4 )2 SO4是强酸弱碱盐,NH4+会要发生水解:NH4 +H2O![]() NH3·H2O+H+ ,溶液呈酸性,加热水解平衡正向移动,c(H+)增大,pH减小,④符合题意;
NH3·H2O+H+ ,溶液呈酸性,加热水解平衡正向移动,c(H+)增大,pH减小,④符合题意;
(4)①A是HCl,E是CH3COOH,若二者的OH-相等,则溶液中H+的浓度也相等,由于醋酸是弱酸,溶液中存在电离平衡,电离产生的离子浓度远小于酸分子的浓度,所以c(CH3COOH)>c(HCl),根据酸能与锌反应得到氢气,随着反应的进行,CH3COOH不断电离出H+,反应速率比盐酸中快,产生的氢气一样多,反应所需要的时间HCl>CH3COOH,错误;②根据酸能与锌反应得到氢气,开始溶液中c(H+)相等,反应时的速率HCl=CH3COOH,错误;③根据酸能与锌反应得到氢气,若最后仅有一份溶液中存在锌,放出氢气的质量相同,说明盐酸中锌剩余,CH3COOH中锌完全反应,参加反应的锌的物质的量相等,正确;④根据酸能与锌反应得到氢气,随着反应的进行,CH3COOH不断电离出H+,反应速率比盐酸中快,正确;⑤根据酸能与锌反应得到氢气,若最后仅有一份溶液中存在锌,放出氢气的质量相同,说明盐酸中锌剩余,正确;⑥根据酸能与锌反应得到氢气,若最后仅有一份溶液中存在锌,放出氢气的质量相同,说明盐酸中锌剩余,错误。故说法正确的是③④⑤。

 名校课堂系列答案
名校课堂系列答案