题目内容
【化学--选修3:物质结构与性质】
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
(1)G位于______族______区,价电子排布式为______.
(2)B基态原子中能量最高的电子,其电子云在空间有______个方向,原子轨道呈______
形.
(3)画出C原子的电子排布图______.
(4)已知BA5为离子化合物,写出其电子式______.
(5)DE3中心原子的杂化方式为______,用价层电子对互斥理论推测其空间构型为______.
(6)用电子式表示F元素与E元素形成化合物的形成过程______.
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/molI2=1451kJ/molI3=7733kJ/molI4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
(2)B基态原子中能量最高的电子,其电子云在空间有______个方向,原子轨道呈______
形.
(3)画出C原子的电子排布图______.
(4)已知BA5为离子化合物,写出其电子式______.
(5)DE3中心原子的杂化方式为______,用价层电子对互斥理论推测其空间构型为______.
(6)用电子式表示F元素与E元素形成化合物的形成过程______.
A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大,A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素,为H元素;
B元素原子的核外p电子数比s电子数少1,且B是短周期元素,如果B是第三周期元素,则不可能出现p电子比s电子少1,则B为第二周期元素,为N元素;
C的原子序数大于B且为短周期元素,根据C的电离能知,C属于第ⅢA族元素,为Al元素;
D原子核外所有p轨道全满或半满且为短周期主族元素,原子序数大于C,则D是P元素;
E元素的主族序数与周期数的差为4,且E为短周期主族元素,E的原子序数大于D,则E是Cl元素;
F是前四周期中电负性最小的元素,即为最活泼的金属元素,为K元素;
G在周期表的第七列,且为第四周期元素为Mn元素,
(1)G为Mn元素,是25号元素,位于第四周期第ⅦB族,最后填充的为d电子,为d区元素,价电子排布式为3d54s2,
故答案为:ⅦB;d;3d54s2;
(2)B为N元素,核外电子排布式为1s2ns2np3,基态原子中能量最高的电子,处于2p能级,有3个电子,其电子云在空间有3个方向,原子轨道呈纺锤或哑铃形,
故答案为:3;纺锤或哑铃形;
(3)C是Al元素,根据构造原理知,其原子核外电子排布图为: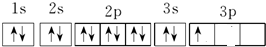 ,
,
故答案为: ;
;
(4)NH5为离子化合物,是由NH4+与H-两种粒构成,电子式为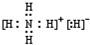 ,
,
故答案为: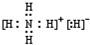 ;
;
(5)PCl3中心原子P原子成3个σ键,P原子价层电子对是为3+1=4,含有1对孤对电子对,杂化轨道数为4,杂化方式为sp3,其空间构型为三角锥,
故答案为:sp3;三角锥;
(6)钾原子和氯原子通过得失电子形成离子键,用电子式表示其形成过程为: ,
,
故答案为: .
.
B元素原子的核外p电子数比s电子数少1,且B是短周期元素,如果B是第三周期元素,则不可能出现p电子比s电子少1,则B为第二周期元素,为N元素;
C的原子序数大于B且为短周期元素,根据C的电离能知,C属于第ⅢA族元素,为Al元素;
D原子核外所有p轨道全满或半满且为短周期主族元素,原子序数大于C,则D是P元素;
E元素的主族序数与周期数的差为4,且E为短周期主族元素,E的原子序数大于D,则E是Cl元素;
F是前四周期中电负性最小的元素,即为最活泼的金属元素,为K元素;
G在周期表的第七列,且为第四周期元素为Mn元素,
(1)G为Mn元素,是25号元素,位于第四周期第ⅦB族,最后填充的为d电子,为d区元素,价电子排布式为3d54s2,
故答案为:ⅦB;d;3d54s2;
(2)B为N元素,核外电子排布式为1s2ns2np3,基态原子中能量最高的电子,处于2p能级,有3个电子,其电子云在空间有3个方向,原子轨道呈纺锤或哑铃形,
故答案为:3;纺锤或哑铃形;
(3)C是Al元素,根据构造原理知,其原子核外电子排布图为:
 ,
,故答案为:
 ;
;(4)NH5为离子化合物,是由NH4+与H-两种粒构成,电子式为
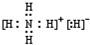 ,
,故答案为:
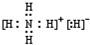 ;
;(5)PCl3中心原子P原子成3个σ键,P原子价层电子对是为3+1=4,含有1对孤对电子对,杂化轨道数为4,杂化方式为sp3,其空间构型为三角锥,
故答案为:sp3;三角锥;
(6)钾原子和氯原子通过得失电子形成离子键,用电子式表示其形成过程为:
 ,
,故答案为:
 .
.
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

 。下列说法正确的是
。下列说法正确的是