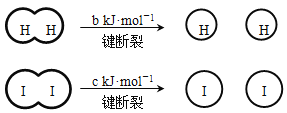
题目内容
【题目】某同学组装了如图所示的电化学装置,其中电极I为Al,其它均为Cu,下列说法正确的是( )

A. 装Al2(SO4)3溶液的烧杯是原电池,其余两个为电解(电镀)池
B. 盐桥中电子从右侧流向左侧
C. 电极II逐渐溶解
D. 电极IV的电极反应:Cu2+ + 2e-= Cu
【答案】D
【解析】试题分析:A、由原电池的构成条件及题意可知,图中左、中两个烧杯中电解质溶液、盐桥和外电路组成1个原电池,右边烧杯为电解(或电镀)池,A错误;B、I中较活泼的Al电极为负极,II中较不活泼的Cu为正极,外电路(导线)中电子从左流向右,内电路(含盐桥)中带正电的阳离子从左侧流向右侧,带负电的阴离子从右侧流向左侧,内电路中无电子的定向移动,B正确;C、负极反应式为Al-3e-=Al3+,则电极I逐渐溶解或被腐蚀,而作为正极的II则受到保护,C错误;D、III为阴极,内电路中带正电的铜离子移向阴极,则阴极反应式为Cu2+ + 2e-= Cu,IV是阳极,则阳极反应式为Cu- 2e-= Cu2+,D错误;答案选D。

 名校课堂系列答案
名校课堂系列答案【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | ||
铝 | X | 硫 | Z |
请回答下列问题:
(1)Z元素在周期表中的位置为_______________。
(2)表中元素原子半径最大的非金属是(元素符号)_______________。
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是_______________;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1 mol Y单质比1 mol S得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)碳与镁形成的1 mol 化合物Q与水反应,生成2 mol Mg(OH)2和1 mol烃,该烃分子中碳氢质量比为9:1。Q的化学式为_____________________。
(5)向氯化铝溶液中加入过量氨水,离子方程式为 。
(6)将SO2通入稀硝酸中,反应的离子方程式为 。
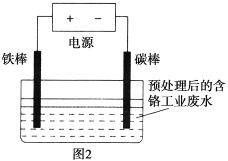
【题目】铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的工艺如下(部分操作和条件略):
Ⅰ.将铬铁矿和碳酸钠混合在空气中充分焙烧。
Ⅱ.焙烧后的固体加水浸取,分离得到溶液A和固体A。
Ⅲ.向溶液A中加入醋酸调pH约7~8,分离得到溶液B和固体B。
Ⅳ.再向溶液B中继续加醋酸酸化,使溶液pH小于5。
Ⅴ.向上述溶液中加入氯化钾,得到重铬酸钾晶体。
(1)Ⅰ中焙烧发生的反应如下,配平并填写空缺:
① FeOCr2O3 + Na2CO3 + □ = Na2CrO4 + Fe2O3 + CO2↑
② Na2CO3+Al2O3=2NaAlO2+CO2↑
(2)固体A中主要含有 (填写化学式)。
(3)Ⅴ中发生反应的化学方程式是:Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl,已知下表数据
物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
溶解度 (g/100g水) | 0℃ | 28 | 35.7 | 4.7 | 163 |
40℃ | 40.1 | 36.4 | 26.3 | 215 | |
80℃ | 51.3 | 38 | 73 | 376 | |
获得K2Cr2O7晶体的操作由多步组成,依次是:加入KCl固体、 、过滤、洗涤、干燥得到晶体。洗涤沉淀的操作为 。
(4)Ⅲ中固体B中主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析固体B中氢氧化铝含量的方法是:称取n g样品,加入过量 (填写试剂名称)、溶解、过滤、再通入过量的CO2、灼烧、冷却、称量,得干燥固体m g。计算样品中氢氧化铝的质量分数为 (用含m、n的代数式表示)。