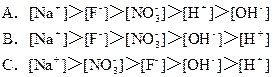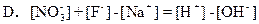题目内容
A、B、C、D、E五种溶液分别是NaOH、NH3?H2O、CH3COOH、HCl、NH4HSO4中一种.常温下进行下列实验:
①将1LpH=3的A溶液分别与0.001mol?L-1xLB溶液、0.001mol?L-1yLD溶液充分反应后溶液呈中性,x、y大小关系为:y<x;
②浓度均为0.1mol?L-1A和E溶液,pH:A<E;
③浓度均为0.1mol?L-1C与D溶液等体积混合,溶液呈酸性.
回答下列问题:
(1)D是______溶液
(2)用水稀释0.1mol?L-1B时,溶液中随着水量的增加而减小的是______(填写序号)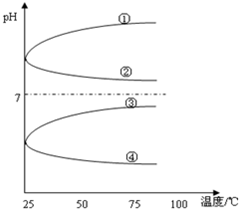
①
;②
;
③c(H+)和c(OH-)的乘积④OH-的物质的量
(3)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不会分解)溶液pH随温度变化如图中的______曲线(填写序号).
(4)OH-浓度相同的等体积的两份溶液A和E,分别和锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是______(填写序号)
①反应所需要的时间E>A
②开始反应时的速率A>E
③参加反应的锌的物质的量A=E
④反应过程的平均速率E>A
⑤A溶液里有锌剩余
⑥E溶液里有锌剩余
(5)室温下,向0.01mol?L-1C溶液中滴加0.01mol?L-1D溶液至中性得到的溶液中所有离子的物质的量浓度大小关系为______.
①将1LpH=3的A溶液分别与0.001mol?L-1xLB溶液、0.001mol?L-1yLD溶液充分反应后溶液呈中性,x、y大小关系为:y<x;
②浓度均为0.1mol?L-1A和E溶液,pH:A<E;
③浓度均为0.1mol?L-1C与D溶液等体积混合,溶液呈酸性.
回答下列问题:
(1)D是______溶液
(2)用水稀释0.1mol?L-1B时,溶液中随着水量的增加而减小的是______(填写序号)

①
| c(B) |
| c(OH-) |
| c(OH-) |
| c(H+) |
③c(H+)和c(OH-)的乘积④OH-的物质的量
(3)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不会分解)溶液pH随温度变化如图中的______曲线(填写序号).
(4)OH-浓度相同的等体积的两份溶液A和E,分别和锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是______(填写序号)
①反应所需要的时间E>A
②开始反应时的速率A>E
③参加反应的锌的物质的量A=E
④反应过程的平均速率E>A
⑤A溶液里有锌剩余
⑥E溶液里有锌剩余
(5)室温下,向0.01mol?L-1C溶液中滴加0.01mol?L-1D溶液至中性得到的溶液中所有离子的物质的量浓度大小关系为______.
(1)中和酸性物质A只有NaOH、NH3?H2O,物质的量的A与等物质的量浓度B和D混合呈中性,D的用量少,说明D碱性比B的碱性强,所以D是NaOH,故答案为:NaOH;
(2)①、由NH3?H2O?OH-+NH4+可知,加水促进电离,则n(NH3?H2O)减少,n(OH-)增大,则
=
减小,故①错误;
②、由NH3?H2O?OH-+NH4+可知,加水促进电离,则n(NH3?H2O)减少,n(OH-)增大,c(NH3?H2O)、c(OH-)都减小,c(H+)减小,则
减小,故②正确;
③、因加水稀释时,温度不变,则c(H+)和c(OH-)的乘积不变,故③错误;
④、由NH3?H2O?OH-+NH4+可知,加水促进电离,OH-的物质的量增大,故④错误;
故答案为:①②;
(3)等体积、等物质的量浓度NH3?H2O和与NH4HSO4混合后溶液发生反应:NH3?H2O+NH4HSO4=(NH4)2SO4+H2O,NH4)2SO4要发生水NH4++H2O?NH3?H2O+H+,溶液呈酸性,加热水解平衡正向移动,c(H+)增大,pH减小,故答案为:④;
(4)①根据酸能与锌反应得到氢气,随着反应的进行,CH3COOH不断电离出H+,反应速率比盐酸中快,产生的氢气一样多,反应所需要的时间HCl>CH3COOH,故①错误;
②根据酸能与锌反应得到氢气,开始溶液中c(H+)相等,反应时的速率HCl=CH3COOH,故②错误;
③根据酸能与锌反应得到氢气,若最后仅有一份溶液中存在锌,放出氢气的质量相同,说明盐酸中锌剩余,CH3COOH中锌完全反应,参加反应的锌的物质的量相等,故③正确;
④根据酸能与锌反应得到氢气,随着反应的进行,CH3COOH不断电离出H+,反应速率比盐酸中快,故④正确;
⑤根据酸能与锌反应得到氢气,若最后仅有一份溶液中存在锌,放出氢气的质量相同,说明盐酸中锌剩余,CH3COOH中锌完全反应,参加反应的锌的物质的量相等,故⑤正确;
⑥根据酸能与锌反应得到氢气,若最后仅有一份溶液中存在锌,放出氢气的质量相同,说明盐酸中锌剩余,CH3COOH中锌完全反应,参加反应的锌的物质的量相等,故⑥错误;
故答案为:③④⑤;
(5)NH4HSO4中滴入NaOH溶液,NaOH首先与NH4HSO4电离出的H+作用,因为H+结合OH-的能力比NH4+结合OH-的能量强(原因是产物H2O比NH3?H2O更难电离).当加入等摩尔的NaOH时,正好将H+中和,此时c(Na+)=c(SO42-),但此时溶液中还有NH4+,NH4+水解使溶液呈酸性,因此要使溶液呈中性,则还需继续滴入NaOH,当然到中性时c(OH-)=c(H+),c(Na+)>c(SO42- )>c(NH4+),故答案为:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).
(2)①、由NH3?H2O?OH-+NH4+可知,加水促进电离,则n(NH3?H2O)减少,n(OH-)增大,则
| C(NH3?H2O) |
| C(OH-) |
| n(NH3?H2O) |
| n(OH-) |
②、由NH3?H2O?OH-+NH4+可知,加水促进电离,则n(NH3?H2O)减少,n(OH-)增大,c(NH3?H2O)、c(OH-)都减小,c(H+)减小,则
| c(OH-) |
| c(H+) |
③、因加水稀释时,温度不变,则c(H+)和c(OH-)的乘积不变,故③错误;
④、由NH3?H2O?OH-+NH4+可知,加水促进电离,OH-的物质的量增大,故④错误;
故答案为:①②;
(3)等体积、等物质的量浓度NH3?H2O和与NH4HSO4混合后溶液发生反应:NH3?H2O+NH4HSO4=(NH4)2SO4+H2O,NH4)2SO4要发生水NH4++H2O?NH3?H2O+H+,溶液呈酸性,加热水解平衡正向移动,c(H+)增大,pH减小,故答案为:④;
(4)①根据酸能与锌反应得到氢气,随着反应的进行,CH3COOH不断电离出H+,反应速率比盐酸中快,产生的氢气一样多,反应所需要的时间HCl>CH3COOH,故①错误;
②根据酸能与锌反应得到氢气,开始溶液中c(H+)相等,反应时的速率HCl=CH3COOH,故②错误;
③根据酸能与锌反应得到氢气,若最后仅有一份溶液中存在锌,放出氢气的质量相同,说明盐酸中锌剩余,CH3COOH中锌完全反应,参加反应的锌的物质的量相等,故③正确;
④根据酸能与锌反应得到氢气,随着反应的进行,CH3COOH不断电离出H+,反应速率比盐酸中快,故④正确;
⑤根据酸能与锌反应得到氢气,若最后仅有一份溶液中存在锌,放出氢气的质量相同,说明盐酸中锌剩余,CH3COOH中锌完全反应,参加反应的锌的物质的量相等,故⑤正确;
⑥根据酸能与锌反应得到氢气,若最后仅有一份溶液中存在锌,放出氢气的质量相同,说明盐酸中锌剩余,CH3COOH中锌完全反应,参加反应的锌的物质的量相等,故⑥错误;
故答案为:③④⑤;
(5)NH4HSO4中滴入NaOH溶液,NaOH首先与NH4HSO4电离出的H+作用,因为H+结合OH-的能力比NH4+结合OH-的能量强(原因是产物H2O比NH3?H2O更难电离).当加入等摩尔的NaOH时,正好将H+中和,此时c(Na+)=c(SO42-),但此时溶液中还有NH4+,NH4+水解使溶液呈酸性,因此要使溶液呈中性,则还需继续滴入NaOH,当然到中性时c(OH-)=c(H+),c(Na+)>c(SO42- )>c(NH4+),故答案为:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).

练习册系列答案
相关题目