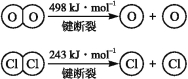
题目内容
【题目】下列各分子中,化学键类型有差异的是
A. H2O、CO2 B. MgF2、H2O2
C. NaOH、Ba(OH)2 D. NaCl、KCl
【答案】B
【解析】试题分析:A、水分子中H原子和O原子之间只存在极性键,二氧化碳分子中C原子和O原子之间只存在极性键,化学键类型相同;B、氟化镁中只存在离子键,双氧水分子中H原子和O原子之间存在极性键、O原子之间存在非极性键,化学键类型不同;C、氢氧化钠和氢氧化钡中金属阳离子和氢氧根离子之间存在离子键,O原子和H原子之间存在极性键,化学键类型相同;D.氯化钠和氯化钾中氯离子和金属阳离子之间只存在离子键,化学键类型相同,故答案为B。

 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案【题目】已知:Na2S2O3+H2SO4===Na2SO4+SO2↑+S↓+H2O,下列各组实验中,反应速率最快的是
组号 | 反应 | Na2S2O3 | H2SO4 | H2O | ||
体积/ mL | 浓度/ mol·L-1 | 体积/ mL | 浓度/ mol·L-1 | 体积/ mL | ||
A | 10 | 5 | 0.2 | 5 | 0.1 | 10 |
B | 10 | 5 | 0.1 | 5 | 0.1 | 10 |
C | 30 | 5 | 0.1 | 5 | 0.1 | 10 |
D | 30 | 5 | 0.2 | 5 | 0.2 | 10 |
A. A B. B C. C D. D
【题目】二氧化碳的回收利用是环保领域研究的热点课题。
(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如图1所示,其总反应的化学方程式为_________。

(2)CO2经过催化氢化合成低碳烯烃.其合成乙烯的反应为2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g)△H,几种物质的能量(在标准状况下,规定单质的能量为0,测得其他物质在生成时所放出或吸收的热量)如下表所示:
CH2=CH2(g)+4H2O(g)△H,几种物质的能量(在标准状况下,规定单质的能量为0,测得其他物质在生成时所放出或吸收的热量)如下表所示:
物质 | H2(g) | CO2(g) | CH2=CH2(g) | H2O(g) |
能量/kJmol-1 | 0 | -394 | 52 | -242 |
则△H=_________。
(3)在2L恒容密闭容器中充入2molCO2和nmolH2,在一定条件下发生(2)中的反应,CO2的转化率与温度、投料比[X= ![]() ]的关系如图2所示。
]的关系如图2所示。
①X1_________X2(填“>”、“<”或“=”,下同),平衡常数KA_________KB.
②若B点的投料比为3,且从反应开始到B点需要10min,则v(H2)=_________。
(4)以稀硫酸为电解质溶液,利用太阳能将CO2转化为低碳烯烃,工作原理图如图3。
①b电极的名称是_________;
②产生丙烯的电极反应式为_______________。