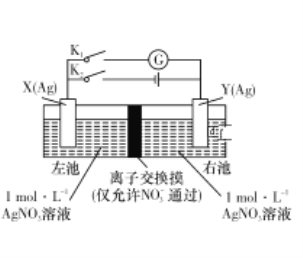
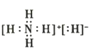��Ŀ����
����Ŀ��С��ͬѧ�����������������ϣ�
����ԭ���ӻ����͵��жϷ�����
(1)��ʽ��n=(����ԭ�ӵļ۵�����+��λԭ�ӵijɼ������������)/2
˵������λԭ��Ϊ��ԭ�ӻ���ԭ��ʱ���ɼ���������Ϊ0���������Ϊ��ֵʱ����ʽ��ȡ��-���ţ��������Ϊ��ֵʱ����ʽ��ȡ��+���š�
(2)����nֵ�ж��ӻ����ͣ�
��n=2ʱΪ![]() �ӻ���n=3ʱΪ
�ӻ���n=3ʱΪ![]() �ӻ���n=4ʱΪ
�ӻ���n=4ʱΪ![]() �ӻ���
�ӻ���
�����ø÷���������������![]() ֵ�����ж�����ԭ�ӵ��ӻ����͡�
ֵ�����ж�����ԭ�ӵ��ӻ����͡�
(1)![]() ��n= __________��__________�ӻ���
��n= __________��__________�ӻ���
(2)![]() ��n= __________��__________�ӻ���
��n= __________��__________�ӻ���
(3)![]() ��n= __________��__________�ӻ���
��n= __________��__________�ӻ���
(4)![]() ��n= __________��__________�ӻ���
��n= __________��__________�ӻ���
���𰸡�4 ![]() 3
3 ![]() 4
4 ![]() 3
3 ![]()
��������
����VSEPR���ۺ��ӻ���������жϷ��ӵĿռ乹�ͺ�����ԭ�ӵ��ӻ���ʽ���۲���ӶԸ���=��ԭ�Ӹ���+�µ��ӶԸ������ݴ˷������
VP=BP+LP
VP=2��sp�ӻ���
VP=3��sp2�ӻ���
VP=4��sp3�ӻ���dsp2�ӻ���
��1��NH3����ԭ�ӣ��۲���Ӷ���=3+![]() ��5-3��1��=4���ӻ���ʽsp3�����幹��Ϊ�����ͣ��ʴ�Ϊ��4��
��5-3��1��=4���ӻ���ʽsp3�����幹��Ϊ�����ͣ��ʴ�Ϊ��4��![]() ��
��
��2��NO3������ԭ�ӣ��۲���Ӷ���=3+![]() ��5+1-3��2��=3���ӻ���ʽsp2�����幹��Ϊƽ�������Σ��ʴ�Ϊ��3��sp2��
��5+1-3��2��=3���ӻ���ʽsp2�����幹��Ϊƽ�������Σ��ʴ�Ϊ��3��sp2��
��3��NH4��������ԭ�ӣ��۲���Ӷ���=4+![]() ��5-1-4��1��=4���ӻ���ʽsp3�����幹��Ϊ���������Σ��ʴ�Ϊ��4��
��5-1-4��1��=4���ӻ���ʽsp3�����幹��Ϊ���������Σ��ʴ�Ϊ��4��![]() ��
��
��4��SO2�����м۲���ӶԸ���=��������+�µ��ӶԸ���=2+![]() ��6-2��2��=3��������ԭ�Ӳ���sp2�ӻ���ΪV�νṹ���ʴ�Ϊ��3��sp2��
��6-2��2��=3��������ԭ�Ӳ���sp2�ӻ���ΪV�νṹ���ʴ�Ϊ��3��sp2��

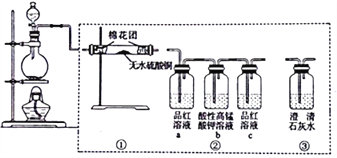
����Ŀ���������Ϊ5mL�ļס��ҡ�������Һ���������Թܱڻ��������Թ��У���������������ͼ��ʾ��ʵ��������ס��ҡ�������Ͽ����ǣ� ��

ѡ�� | �� | �� | �� |
A | 1�� | ˮ | �� |
B | �屽 | Һ�� | �Ҵ� |
C | ˮ | ����ϩ | ��ˮ |
D | �Ҵ� | ���� | �������� |
A.AB.BC.CD.D