题目内容
【题目】二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
① CO(g)+2H2(g)![]() CH3OH(g) △H1=-90.7 kJ·mol-1
CH3OH(g) △H1=-90.7 kJ·mol-1
② 2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-23.5 kJ·mol-1
③ CO(g)+H2O(g)![]() CO2(g)+H2(g) △H3=-41.2kJ·mol-1
CO2(g)+H2(g) △H3=-41.2kJ·mol-1
回答下列问题:
(1)则反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)的△H=______kJ·mol-1。
CH3OCH3(g)+CO2(g)的△H=______kJ·mol-1。
(2)反应①达平衡后采取下列措施,能提高CH3OH产率的有__________。
A.加入H2 B.升高温度 C.增大压强 D.使用催化剂
(3)在一定温度下,将4mol CO和4mol H2混合置于2L的密闭容器中发生反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g),60s时达到平衡状态时,测得气体的总物质的量为4mol。达平衡时,氢气的转化率为__________,用CO表示的反应速率为__________,该反应的平衡常数为__________。
CH3OCH3(g)+CO2(g),60s时达到平衡状态时,测得气体的总物质的量为4mol。达平衡时,氢气的转化率为__________,用CO表示的反应速率为__________,该反应的平衡常数为__________。
(4)以下说法能说明反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)达到平衡状态的有__________。
CH3OCH3(g)+CO2(g)达到平衡状态的有__________。
A. 氢气和二氧化碳的浓度之比为3∶1
B.单位时间内断裂3个H-H同时断裂1个C=O
C.恒温恒容条件下,气体的密度保持不变
D.恒温恒压条件下,气体的平均摩尔质量保持不变
E.绝热体系中,体系的温度保持不变
(5)二甲醚燃料电池的工作原理如图所示:
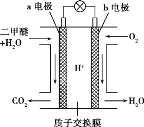
该电池负极的电极反应式为__________。
【答案】-246.1 AC75%1.5mol/(Lmin)或0.025mol/(LS) 16DE3H2O+CH3OCH3-12e-=2CO2+12H+
【解析】
(1)根据盖斯定律,通过①×2+②+③可得反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g), △H=-246.1 kJ·mol-1;综上所述,本题答案是:-246.1。
CH3OCH3(g)+CO2(g), △H=-246.1 kJ·mol-1;综上所述,本题答案是:-246.1。
(2)A.增加H2的浓度,平衡右移, CH3OH产率提高,正确;
B.反应放热,升高温度, 平衡左移,CH3OH产率降低,错误;
C.增大压强,平衡右移, CH3OH产率提高,正确;
D.使用催化剂,可以加快反应速率,平衡不移动,转化率不变,CH3OH产率不变,错误;
综上所述,本题答案是:AC。
(3)将4mol CO和4mol H2混合置于2L的密闭容器中发生反应, 设生成CO2的量为x,则:
3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g),
CH3OCH3(g)+CO2(g),
起始量 4 4 0 0
变化量 3x 3x x x
平衡量 4-3x 4-3x x x
60s时达到平衡状态时,测得气体的总物质的量为4mol,4=4-3x+4-3x+x+x,x=1mol;达平衡时,氢气的转化率为(3×1)/4×100%=75% ;CO变化的浓度为3×1/2=1.5mol/L, CO的反应速率为1.5/60=0.025mol/(LS) (或1.5mol/(Lmin);反应达平衡时各物质浓度分别为:c(H2)=(4-3)/2=0.5mol/L, c(CO)=(4-3)/2=0.5mol/L, c(CH3OCH3)=1/2=0.5 mol/L,c(CO2)= 1/2=0.5 mol/L, 该反应的平衡常数=c(CO2)c(CH3OCH3)/c3(H2)c3(CO)= 0.52/0.56=16;综上所述,本题答案是:75%,0.025mol/(LS) (或1.5mol/(Lmin)),16。
(4)A.不清楚开始时通入量是多少,因此两者浓度比为3:1,无法判断是否达到平衡,故A错误;
B.断裂3个H-H键,消耗3个H2,断裂1个C=O 键,消耗0.5个CO2,两者比值不等于化学计量数之比,因此不能说明反应达到平衡,故B错误;
C.组分都是气体,因此气体质量不变,又是恒容状态,体积不变,根据密度的定义,密度始终不变,因此密度不变,不能说明反应达到平衡,故C错误;
D.组分都是气体,气体质量不变,但反应前后气体系数之和不等,根据摩尔质量的定义,摩尔质量发生变化,因此当平均摩尔质量不变,说明反应达到平衡,故D正确;
E.是绝热容器,温度发生变化,当温度不再改变,说明反应达到平衡,故E正确;
综上所述,本题选DE。
(5)该电池为原电池,二甲醚在负极发生氧化反应,生成二氧化碳,电解质为酸性溶液,所以负极的电极反应式为3H2O+CH3OCH3-12e-=2CO2+12H+;综上所述,本题答案是:3H2O+CH3OCH3-12e-=2CO2+12H+。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案